Hintergrund
Artemisia annua ist eine chinesische Heilpflanze (auch bekannt als „qing hao“ oder „süßer Wermut“) mit nachgewiesener Anti-Malaria-Aktivität (1). Kombinationstherapien auf der Basis von Artemisinin-Derivaten (ACTs) werden von der Weltgesundheitsorganisation (WHO) zur Behandlung unkomplizierter Malaria in Kombination mit wirksamen Malariamitteln empfohlen (2). Die Chemoprophylaxe für Reisende hängt vom Malaria-endemischen Reiseziel ab und umfasst eine Kombination aus Atovaquon/Proguanil, Chloroquin, Doxycyclin, Mefloquin oder Primaquin (3, 4). Es wurden Fälle von Malariainfektionen unter einer Chemoprophylaxe mit Artemisinin-Derivaten beschrieben (5), und die WHO empfiehlt die Verwendung von A. annua-Pflanzenmaterial in jeglicher Form, einschließlich Tee, zur Behandlung oder Vorbeugung von Malaria nicht (6).
Kräuter- und Nahrungsergänzungsmittel (HDS) werden weltweit in zunehmendem Maße verwendet, und HDS-induzierte Leberschäden geben zunehmend Anlass zur Sorge (7). Trotz des umfassenden Einsatzes von ACTs in Malaria-Endemiegebieten sind Leberschäden durch Artemisinin-Derivate selten (8, 9). Kumar berichtete über den Fall eines Patienten, der 6 Wochen nach der oralen Einnahme eines Artemisinin-haltigen pflanzlichen Ergänzungsmittels zur allgemeinen Gesundheitspflege eine cholestatische Leberschädigung entwickelte (10). Es gibt noch einige andere Veröffentlichungen über Artemisia annua-induzierte Leberschäden (9, 11-14). Eine klinische Leitlinie für die Bewertung der Kausalität und die Diagnose von kräuterinduzierten Leberschäden wurde kürzlich von der Chinese Association of Chinese Medicine vorgeschlagen (15). Wir stellen einen Fall einer akuten cholestatischen Hepatitis vor, die auf die Einnahme von Artemisia-Tee als Chemoprophylaxe bei einem aus Äthiopien zurückkehrenden Patienten zurückzuführen ist.
Fallbericht
Ein 51-jähriger Mann stellte sich in der Notaufnahme des Universitätsspitals Basel, Schweiz, mit Unwohlsein, abdominalen Beschwerden, gelbem Schwebestuhl, Gelbsucht und Cholurie von 4 Tagen Dauer und einem Gewichtsverlust von 6-8 kg in den letzten 6 Wochen vor. Er war 3 Wochen vor der Inanspruchnahme der medizinischen Versorgung von einer 4-wöchigen Reise nach Äthiopien zurückgekehrt. Während seines Aufenthalts in Äthiopien nahm er täglich 1,25 g Artemisia annua-Pulvertee als Chemoprophylaxe gegen Malaria zu sich. In etwa 90 % der Fälle verdünnte er das Pulver in kochendem Wasser, in den restlichen 10 % wurde das Pulver mit der Nahrung vermischt eingenommen. Das Präparat war über das Internet erworben worden. Der Patient stellte uns den Behälter zur Verfügung, der ursprünglich 50 g eines dunkelgrünen Pulvers enthalten hatte (Abbildung 1). Bei der Vorstellung befanden sich 2 g in der Dose, was darauf hindeutet, dass er insgesamt 48 g konsumiert hatte. Während seines Aufenthalts in Äthiopien hatte er auch andere teeähnliche Zubereitungen konsumiert. Unseres Wissens ist keine Hepatotoxizität im Zusammenhang mit diesen Substanzen beschrieben worden. Er verneinte die Einnahme anderer verschreibungspflichtiger, rezeptfreier oder pflanzlicher Medikamente. Er hatte keine Vorgeschichte oder Familiengeschichte von Lebererkrankungen, Alkohol- oder Drogenmissbrauch oder Risikofaktoren für Virushepatitis. Er berichtete, dass seine Frau, die ihn auf seiner Reise nach Äthiopien begleitete, ebenfalls Artemesia annua-Tee zur Malariaprophylaxe getrunken hatte. Sie blieb durchweg gesund.

Abbildung 1. Artemisia annua Pulvertee.
Abgesehen von einer ausgeprägten Gelbsucht, war er in einem guten Allgemeinzustand und hatte unauffällige Vitalzeichen (afebril mit normalem Blutdruck, Herzfrequenz und Atemfrequenz).
Laboruntersuchungen ergaben: Alanin-Aminotransferase (ALAT) 91 U/L (normal, 9-59); Aspartat-Aminotransferase (ASAT) 42 U/L (normal, 9-34); alkalische Phosphatase (ALP) 151 U/L (normal, 40-130); Gamma-Glutamyl-Transferase (GGT) 416 U/L (normal, 12-68); Gesamtbilirubin 186.6 μmol/L (normal, 0-24) (konjugiertes Bilirubin 168,5 μmol/L); und international normalized ratio (INR) 0,9 (normal, 0,9-1,3). Der Gallensäurespiegel war auf einen Wert von 460,5 μmol/L erhöht (normal, 0-8,0). Das Differentialblutbild und das c-reaktive Protein waren normal. Es lag eine leichte Hyponatriämie und Hypochlorämie vor, was auf die erhöhte Wasseraufnahme des Patienten in den vorangegangenen Tagen zurückzuführen war. Serologische Tests auf akute Hepatitis A, B, C und E, Epstein-Barr-Virus und Zytomegalievirus-Infektion waren negativ. Coeruloplasmin war normal. Die leberspezifischen Autoantikörper (anti-nukleäre Antikörper, anti-neutrophile Antikörper, anti-smooth muscle-Antikörper, anti-mitochondriale Antikörper, anti-Proteinase 3-Antikörper und anti-Myeloperoxidase-Antikörper) waren negativ und IgA, IgM und IgG lagen im Normbereich. Die abdominale Ultraschalluntersuchung zeigte ein normales Leberparenchym, normale Gefäße und Gallengänge. Die Leberelastographie war erhöht (FibroScan, 12,7 kPa, Normalbereich <5 kPa).
Der Patient wurde außerdem im Schweizerischen Tropen- und Public Health-Institut auf verschiedene mögliche infektiöse Grunderkrankungen untersucht. Es wurden Antikörper gegen Rickettsien festgestellt, die jedoch nicht mit dem klinischen Bild in Verbindung gebracht wurden, und es wurde keine Antibiotikatherapie eingeleitet.
Die erste Leberbiopsie zeigte eine portale Hepatitis mit lymphozytärer Infiltration der Gallengänge und diffuser intrakanälischer und intrazytoplasmatischer Bilirubinostase. Es wurde weder eine Fibrose noch parasitäres Material festgestellt (Abbildungen 2A und B). Eine Next Generation Sequencing-Analyse von DNA aus peripheren Blutleukozyten auf genetische Varianten in den Genen, die für die drei wichtigsten hepatischen Transporter für die Gallensäure-Homöostase, nämlich BSEP, MDR3 und FIC1, kodieren, ergab keine Varianten, die typischerweise mit erblichen cholestatischen Lebererkrankungen assoziiert sind.
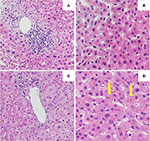
Abbildung 2. Histologie der ersten (A,B) und zweiten (C,D) Leberbiopsie. (A) Low-Power-Ansicht der Leberbiopsie, die ein portales lymphozytäres Infiltrat zeigt. (B) Leberparenchym mit intrazellulärer Bilirubinostase (HE, 20x). (C) Ansicht der Leberbiopsie bei geringer Vergrößerung ohne signifikante Entzündung der Pfortader (HE, 10x). (D) Leberparenchym mit signifikanter intrazellulärer und extrazellulärer (Pfeil) Bilirubinostase (HE, 20x).
Die toxikologische Analyse des Artemisia-Tees mittels Flüssigchromatographie-Massenspektrometrie und Gaschromatographie-Massenspektrometrie ergab die folgenden Inhaltsstoffe: Arteannuin b, Desoxyartemisin, Kampfer und Scopoletin.
Eine Behandlung mit Prednison 20 mg zweimal täglich und Ursodeoxycholsäure 500 mg zweimal täglich wurde eingeleitet. Aufgrund der anhaltenden Gelbsucht sowie des trotz der Behandlung über 4 Wochen ansteigenden Bilirubins wurde eine zweite Leberbiopsie durchgeführt. Die zweite Biopsie zeigte eine schwere intrazytoplasmatische sowie intrakanalikuläre Bilirubinostase, wobei die Entzündung im Vergleich zur ersten Biopsie nur minimal war (Abbildungen 2C und D). Die Kortikosteroid-Behandlung wurde abgesetzt, die Ursodeoxycholsäure wurde bis zum Verschwinden der Gelbsucht und der Normalisierung des Bilirubins (15,3 μmol/l) (Abbildung 3) und der relevanten Abnahme der Gallensäuren (19,5 μmol/l) fortgesetzt, die drei Monate nach Beginn der Erkrankung eintrat.
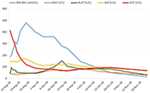
Abbildung 3. Verlauf von Bilirubin und Leberenzymen im Laufe der Zeit.
Der Fall wurde der Pharmakovigilanzstelle der Schweizerischen Heilmittelbehörde (Swissmedic) gemeldet. Für die Veröffentlichung dieses Fallberichts wurde die schriftliche Einwilligung des Teilnehmers eingeholt.
Diskussion
Artemisinin-Derivate sind ein Eckpfeiler für die Behandlung, nicht aber für die Chemoprävention von Malaria (2). Trotz ihrer weit verbreiteten Anwendung sind Leberschäden durch Artemisinin-Derivate nur selten beschrieben worden (8, 10). Soweit wir wissen, ist dies der erste Fallbericht über eine akute cholestatische Hepatitis, die auf die Einnahme von Artemisia annua-Tee zurückzuführen ist.
Kräuter- und Nahrungsergänzungsmittel-induzierte Leberschäden sind ein Thema von wachsendem Interesse, da HDS weltweit zunehmend verwendet werden (7). Die Einnahme von Nahrungsergänzungsmitteln wird häufig als harmlos angesehen, jedoch wurde über eine zunehmende Zahl von unerwünschten Ereignissen berichtet, die im Zusammenhang mit ihrer Verwendung auftreten (16). Da die Konzentration und Zusammensetzung von HDS häufig nicht auf den Produktetiketten angegeben sind, bleiben Qualität und Quantität der Inhaltsstoffe des Produkts unbekannt. In unserem Fall basierte die Diagnose einer HDS-induzierten Leberschädigung aufgrund der Einnahme von Artemisia annua-Tee auf dem engen zeitlichen Zusammenhang zwischen der Exposition und der Entwicklung der unerwünschten Reaktion und dem Fehlen anderer möglicher Ursachen. Wir berechneten den Kausalitätsbewertungs-Score nach der RUCAM (Roussel Uclaf Causality Assessment Method) (17) und erhielten eine Punktzahl von 6, was einer „wahrscheinlichen“ Kausalität der inkriminierten Droge entspricht. Die einzelnen Punkte wurden wie folgt bewertet: Zeitpunkt des Auftretens (+2), Verlauf (+1), Risikofaktoren (+1), Begleitmedikamente (-1), Ausschluss anderer Ursachen für die Leberschädigung (+2), frühere Informationen über die Hepatotoxizität des Medikaments (+1), Reaktion auf die erneute Verabreichung (0). Es gab keine anderen erkennbaren Ursachen für die Lebererkrankung.
Der zuvor von Kumar beschriebene Fall wies ein hepatozelluläres Muster der Leberschädigung auf, gefolgt von einer verlängerten cholestatischen Phase (10). Unser Patient zeigte 5 Wochen nach der ersten Einnahme von Artemisia annua-Tee ein überwiegend cholestatisches Muster der Leberschädigung. Wir gehen davon aus, dass der natürliche Verlauf ähnlich wie bei Kumar war, dass sich unser Patient jedoch zu einem späteren Zeitpunkt in der Entwicklung der Leberschädigung vorstellte. Bei der toxikologischen Analyse des eingenommenen Kräutertees identifizierten wir zusätzlich Scopoletin und Kampfer, die natürlicherweise in Artemisia annua vorkommen (18, 19) und möglicherweise zum Ausbruch der cholestatischen Leberschädigung beigetragen haben.
Der Mechanismus der durch Artemisinin-Derivate induzierten Leberschädigung bleibt unklar. Zu den chemischen Bestandteilen von Artemisiae spp. gehören ätherische Öle, Flavonoide, Tannine, Triterpene und Polysaccharide. Die ätherischen Öle von Artemisiae spp. haben eine starke pharmakologische Wirkung und Toxizität, und ein neuerer bioinformatischer Ansatz identifizierte verschiedene Signalwege, die an der Entwicklung von Leberschäden beteiligt sein könnten (20). Die Prädisposition für arzneimittelinduzierte cholestatische Leberschäden wurde mit Polymorphismen der Gallensalzexportpumpe in Verbindung gebracht (21, 22). Wir suchten daher mittels Next Generation Sequencing nach Varianten in Gallensäuretransportern. Wir konnten keine Deletion, Duplikation oder pathologische Variante in den ABCB11-, ATP8B1- und ABCB4-Gensequenzen (kodierende und flankierende Regionen) nachweisen, die für BSEP, FIC1 bzw. MDR3 kodieren (Abbildung 4). Es wurde jedoch eine Reihe gemeinsamer Sequenzvarianten identifiziert. Unser Patient trug homozygot eine Variante des ABCB11-Gens. Es ist umstritten, ob dieser Polymorphismus mit der gutartigen rezidivierenden und/oder progressiven familiären intrahepatischen Cholestase und der intrahepatischen Cholestase der Schwangerschaft in Verbindung steht (23, 24). Darüber hinaus wurde eine weitere häufige Variante im ABCB11-Gen im heterozygoten Zustand nachgewiesen. Diese Variante wurde mit einer verminderten Proteinexpression (25) und mit primärer biliärer Zirrhose in Verbindung gebracht (26, 27). Beide genetischen Varianten sind jedoch in der Allgemeinbevölkerung viel zu häufig, um kausal für cholestatische Lebererkrankungen zu sein (28). Eine systematische Sequenzierung des Transkriptoms kann in solchen Fällen Varianten in anderen Regionen der Gensequenzen oder in anderen Genen identifizieren, die für andere hepatische Transporter oder Proteine kodieren, die an der Gallenbildung beteiligt sind, wie ABCC2, ABCC3, ABCC4 und Tight Junction Protein 2 (TJP2) (21).
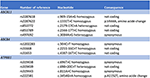
Abbildung 4. Molekulargenetische Analyse der Gene ABCB11, ABCB4 und ATP8B1.
Zusammenfassend beschreiben wir einen Fall einer schweren HDS-bedingten cholestatischen Leberschädigung, die mit der Einnahme von Artemisia annua-Tee vereinbar ist. Es sollten Anstrengungen unternommen werden, um von der Verwendung von Artemisinin-Derivaten zur Malariaprophylaxe abzuraten, die nach den Empfehlungen der WHO unwirksam sind und zusätzlich Schaden anrichten können. Darüber hinaus zeigt der Fall unser noch unzureichendes Verständnis der Pathophysiologie und der Anfälligkeit für HDS-induzierte Leberschäden.
Datenverfügbarkeitserklärung
Alle Datensätze für diese Studie sind im Manuskript/den ergänzenden Dateien enthalten.
Ethikerklärung
Für den Bericht über einen einzelnen klinischen Fall war hier keine ethische Prüfung und Genehmigung erforderlich, in Übereinstimmung mit den lokalen Gesetzen und institutionellen Anforderungen. Der Patient/Teilnehmer gab seine schriftliche Einwilligung zur Teilnahme.
Beiträge der Autoren
FR-R schrieb den ersten Entwurf des Manuskripts. SH, CB, AL-T, MZ und AJ schrieben Teile des Manuskripts. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT und CB trugen zum klinischen Management des Patienten und zur Überarbeitung des Manuskripts bei, lasen und genehmigten die eingereichte Version.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
1. Klayman DL. Qinghaosu (Artemisinin): ein Antimalariamittel aus China. Science. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Weltgesundheitsorganisation. WHO Guidelines for the Treatment of Malaria, 2. Aufl. (2010). Online verfügbar unter: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (Zugriff am 23. November 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Online verfügbar unter: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (Zugriff am 23. November 2018).
Google Scholar
4. Centers for Disease Control and Prevention. Choosing a Drug to Prevent Malaria (2018). Online verfügbar unter: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Artesunat-Missbrauch und Plasmodium falciparum Malaria bei Reisenden, die aus Afrika zurückkehren. Emerg Infect Dis. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. World Health Organization. WHO, Position Statement. Effectiveness of Non-Pharmaceutical Forms of Artemisia annua L. Against Malaria. Geneva: World Health Organization (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Leberschäden durch pflanzliche und Nahrungsergänzungsmittel. Hepatology. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Zwei Fälle von fulminanter Hepatitis während einer kurativen Behandlung mit einer Artesunat-Amodiaquin-Kombination. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centers for Disease Control and Prevention (CDC). Hepatitis in zeitlichem Zusammenhang mit einem Artemisinin-haltigen pflanzlichen Ergänzungsmittel – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Cholestatic liver injury secondary to artemisinin. Hepatology. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. Eine randomisierte, placebokontrollierte klinische Pilotstudie zur Untersuchung der Wirksamkeit und Sicherheit eines Extrakts aus Artemisia annua, verabreicht über 12 Wochen, zur Behandlung von Schmerzen, Steifheit und Funktionseinschränkungen im Zusammenhang mit Arthrose der Hüfte und des Knies. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Potential Risk of Harm to the Liver -Statement Under Section 98 of the Medicines Act 1981 (2018). Online verfügbar unter: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, Clinical and Research Information on Drug-Induced Liver Injury. Artemisinin Derivatives. (2019). Online verfügbar unter: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicity with a Natural Dietary Supplement, Artemisia annua L. Extract in Grapeseed Oil. New Zealand Pharmacovigilance Centre Reports. Drug Safety (2018). In: 18th ISoP Annual Meeting „Pharmacovigilance without borders.“ Geneva (accessed November 11-14, 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Guidelines for the Diagnosis and Management of Herb-Induced Liver Injury. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Trends in der Nutzung von komplementären Gesundheitsansätzen bei Erwachsenen: United States, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM in drug and herb induced liver injury: the update. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Differences in chemical constituents of Artemisia annua L from different geographical regions in China. PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variations in antimalarial components of Artemisia annua Linn from three regions of Uganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Molecular network-based analysis of the mechanism of liver injury induced by volatile oils from Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. Interference with bile salt export pump function is a susceptibility factor for human liver injury in drug development. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Update zur progressiven familiären intrahepatischen Cholestase. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy. Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. Die Rolle des Natrium-Taurocholat-cotransportierenden Polypeptids (NTCP) und der Gallensalzexportpumpe (BSEP) in der Physiologie und Pathophysiologie der Gallebildung. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. BSEP and MDR3 haplotype structure in healthy Caucasians, primary biliary cirrhosis and primary sclerosing cholangitis. Hepatology. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Variations of ABCB4 and ABCB11 genes are associated with primary intrahepatic stones. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. Sequenzierung von FIC1, BSEP und MDR3 in einer großen Kohorte von Patienten mit Cholestase ergab eine hohe Anzahl von verschiedenen genetischen Varianten. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar