Nom générique : éthylsuccinate d’érythromycine
Formation posologique : comprimé, granule pour suspension orale
Médicament revu par Drugs.com. Dernière mise à jour le 1 février 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
Rx only
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l’efficacité de l’E.E.S. et des autres médicaments antibactériens, l’E.E.S. ne doit être utilisé que pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu’elles sont causées par des bactéries.
EES Description
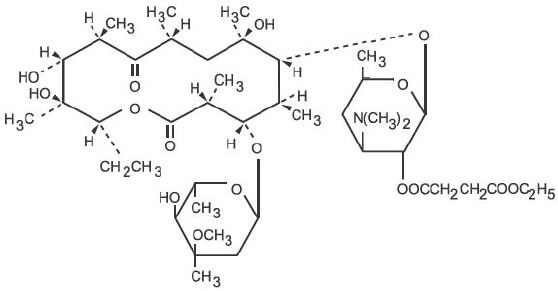
L’érythromycine est produite par une souche de Saccharopolyspora erythraea (anciennement Streptomyces erythraeus) et appartient au groupe des antibiotiques macrolides. Elle est basique et forme facilement des sels avec les acides. La base, le sel stéarate et les esters sont peu solubles dans l’eau. L’éthylsuccinate d’érythromycine est un ester d’érythromycine adapté à l’administration orale. L’éthylsuccinate d’érythromycine est connu chimiquement sous le nom de 2′-(éthylsuccinate) d’érythromycine. La formule moléculaire est C43H75NO16 et le poids moléculaire est 862,06. La formule développée est :
E.E.S. Les granules sont destinés à être reconstitués avec de l’eau. Chaque cuillerée à café de 5 ml de suspension reconstituée à saveur de cerise contient de l’éthylsuccinate d’érythromycine équivalent à 200 mg d’érythromycine.
Les liquides au goût agréable, à saveur de fruits, sont fournis prêts à être administrés par voie orale.
E.E.S. 200 liquide : chaque cuillerée à café de 5 ml de suspension à saveur de fruits contient de l’éthylsuccinate d’érythromycine équivalent à 200 mg d’érythromycine.
E.E.S. 400 liquide : Chaque cuillerée à café de 5 ml de suspension à saveur d’orange contient de l’éthylsuccinate d’érythromycine équivalent à 400 mg d’érythromycine.
Les granules et les suspensions prêtes à l’emploi sont destinées principalement à un usage pédiatrique mais peuvent également être utilisées chez l’adulte.
E.E.S. 400 comprimés pelliculés : Chaque comprimé contient de l’éthylsuccinate d’érythromycine équivalent à 400 mg d’érythromycine.
Les comprimés pelliculés sont destinés principalement aux adultes ou aux enfants plus âgés.
Ingrédients inactifs
E.E.S. Granules : Acide citrique, FD&C rouge n° 3, silicate d’aluminium et de magnésium, carboxyméthylcellulose sodique, citrate de sodium, saccharose et arôme artificiel.
E.E.S. 400 comprimés pelliculés : Polymères cellulosiques, sucre de confiserie (contient de l’amidon de maïs), amidon de maïs, D&C rouge n° 30, D&C jaune n° 10, FD&C rouge n° 40, stéarate de magnésium, polacriline de potassium, polyéthylène glycol, propylène glycol, citrate de sodium, acide sorbique et dioxyde de titane.
E.E.S. 200 liquide : FD&C Rouge n° 40, méthylparabène, polysorbate 60, propylparabène, citrate de sodium, saccharose, eau, gomme xanthane et arômes naturels et artificiels.
E.E.S. 400 Liquide : D&C jaune n° 10, FD&C jaune n° 6, méthylparabène, polysorbate 60, propylparabène, citrate de sodium, saccharose, eau, gomme de xanthane et arômes naturels et artificiels.
EES – Pharmacologie clinique
Les suspensions d’éthylsuccinate d’érythromycine et les comprimés pelliculés administrés par voie orale sont absorbés de manière rapide et fiable. Des taux sériques comparables d’érythromycine sont obtenus à l’état de jeûne et de non-jeûne.
L’érythromycine diffuse facilement dans la plupart des fluides corporels. Seules de faibles concentrations sont normalement atteintes dans le liquide céphalorachidien, mais le passage du médicament à travers la barrière hémato-encéphalique augmente en cas de méningite. En présence d’une fonction hépatique normale, l’érythromycine est concentrée dans le foie et excrétée dans la bile ; l’effet d’un dysfonctionnement hépatique sur l’excrétion de l’érythromycine par le foie dans la bile n’est pas connu. Moins de 5 % de la dose d’érythromycine administrée par voie orale est excrétée sous forme active dans l’urine.
L’érythromycine traverse la barrière placentaire, mais les taux plasmatiques fœtaux sont faibles. Le médicament est excrété dans le lait maternel.
Microbiologie
Mécanisme d’action
L’érythromycine agit par inhibition de la synthèse protéique en se liant aux sous-unités ribosomiques 50S des organismes sensibles. Elle n’affecte pas la synthèse des acides nucléiques.
Résistance
La principale voie de résistance est la modification de l’ARNr 23S de la sous-unité ribosomique 50S jusqu’à l’insensibilité alors que l’efflux peut également être important.
Interactions avec d’autres antimicrobiens
Un antagonisme existe in vitro entre l’érythromycine et la clindamycine, la lincomycine et le chloramphénicol.
Activité antimicrobienne
L’érythromycine s’est révélée active contre la plupart des isolats des micro-organismes suivants, à la fois in vitro et dans des infections cliniques .
Bactéries aérobies
Bactéries gram-positives :
Corynebacterium diphtheriae
Corynebacterium minutissimum
Listeria monocytogenes
Staphylococcus aureus (des organismes résistants peuvent émerger pendant le traitement)
Streptococcus pneumoniae
Streptococcus pyogenes
Bactéries à Gram négatif :
Bordetella pertussis
Haemophilus influenzae
Legionella pneumophila
Neisseria gonorrhoeae
Autres micro-organismes :
Chlamydia trachomatis
Entamoeba histolytica
Mycoplasma pneumoniae
Treponema pallidum
Ureaplasma urealyticum
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. Au moins 90 % des bactéries suivantes présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité de l’érythromycine contre des isolats de même genre ou groupe d’organismes. Cependant, l’efficacité de l’érythromycine dans le traitement des infections cliniques causées par ces bactéries n’a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries aérobies
Bactéries à Gram positif:
Streptocoques du groupe Viridans
Bactéries à Gram négatif:
Moraxella catarrhalis
Tests de sensibilité
Pour des informations spécifiques concernant les critères d’interprétation des tests de sensibilité et les méthodes de test associées ainsi que les normes de contrôle de qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Indications et utilisation de l’EES
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l’efficacité de l’E.E.S. et des autres médicaments antibactériens, l’E.E.S. doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu’elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte dans le choix ou la modification du traitement antibactérien. En l’absence de telles données, l’épidémiologie locale et les profils de sensibilité peuvent contribuer à la sélection empirique du traitement.
E.E.S. est indiqué dans le traitement des infections causées par des souches sensibles des organismes désignés dans les maladies énumérées ci-dessous :
Infections des voies respiratoires supérieures de degré léger à modéré causées par Streptococcus pyogenes, Streptococcus pneumoniae ou Haemophilus influenzae (lorsqu’il est utilisé en concomitance avec des doses adéquates de sulfamides, puisque de nombreuses souches de H. influenzae ne sont pas sensibles aux concentrations d’érythromycine habituellement atteintes). (Voir l’étiquetage approprié des sulfamides pour les informations de prescription.)
Infections des voies respiratoires inférieures de gravité légère à modérée causées par Streptococcus pneumoniae ou Streptococcus pyogenes.
Listeriose causée par Listeria monocytogenes.
Coqueluche (coqueluche) causée par Bordetella pertussis. L’érythromycine est efficace pour éliminer l’organisme du nasopharynx des personnes infectées, les rendant ainsi non infectieuses. Certaines études cliniques suggèrent que l’érythromycine peut être utile dans la prophylaxie de la coqueluche chez les personnes sensibles exposées.
Infections des voies respiratoires dues à Mycoplasma pneumoniae.
Infections de la peau et des structures cutanées de gravité légère à modérée causées par Streptococcus pyogenes ou Staphylococcus aureus (des staphylocoques résistants peuvent apparaître au cours du traitement).
Diphtérie : Infections dues à Corynebacterium diphtheriae, en complément de l’antitoxine, pour prévenir l’établissement de porteurs et pour éradiquer l’organisme chez les porteurs.
Erythrasma : Dans le traitement des infections dues à Corynebacterium minutissimum.
Amébiase intestinale causée par Entamoeba histolytica (érythromycines orales seulement). L’amibiase extra-entérique nécessite un traitement avec d’autres agents.
Maladie inflammatoire pelvienne aiguë causée par Neisseria gonorrhoeae : Comme médicament alternatif dans le traitement de la maladie inflammatoire pelvienne aiguë causée par N. gonorrhoeae chez les patientes ayant des antécédents de sensibilité à la pénicilline. Les patients doivent subir un test sérologique pour la syphilis avant de recevoir l’érythromycine comme traitement de la gonorrhée et un test sérologique de suivi pour la syphilis après 3 mois.
Syphilis causée par Treponema pallidum : L’érythromycine est un choix alternatif de traitement pour la syphilis primaire chez les patients allergiques aux pénicillines. Dans le traitement de la syphilis primaire, des examens du liquide céphalorachidien doivent être effectués avant le traitement et dans le cadre du suivi après le traitement.
Les érythromycines sont indiquées pour le traitement des infections suivantes causées par Chlamydia trachomatis : conjonctivite du nouveau-né, pneumonie du nourrisson et infections urogénitales pendant la grossesse. Lorsque les tétracyclines sont contre-indiquées ou non tolérées, l’érythromycine est indiquée pour le traitement des infections urétrales, endocervicales ou rectales non compliquées chez l’adulte dues à Chlamydia trachomatis.
Lorsque les tétracyclines sont contre-indiquées ou non tolérées, l’érythromycine est indiquée pour le traitement des urétrites nongonococciques causées par Ureaplasma urealyticum.
Maladie des légionnaires causée par Legionella pneumophila : Bien qu’aucune étude d’efficacité clinique contrôlée n’ait été menée, des données in vitro et des données cliniques préliminaires limitées suggèrent que l’érythromycine peut être efficace dans le traitement de la maladie des légionnaires.
Prophylaxie
Prévention des crises initiales de rhumatisme articulaire aigu
La pénicilline est considérée par l’American Heart Association comme le médicament de choix dans la prévention des crises initiales de rhumatisme articulaire aigu (traitement des infections à Streptococcus pyogenes des voies respiratoires supérieures, par ex, amygdalite ou pharyngite). L’érythromycine est indiquée pour le traitement des patients allergiques à la pénicilline.1 La dose thérapeutique doit être administrée pendant 10 jours.
Prévention des crises récurrentes de rhumatisme articulaire aigu
La pénicilline ou les sulfamides sont considérés par l’American Heart Association comme les médicaments de choix pour la prévention des crises récurrentes de rhumatisme articulaire aigu. Chez les patients allergiques à la pénicilline et aux sulfamides, l’érythromycine orale est recommandée par l’American Heart Association dans la prophylaxie à long terme de la pharyngite streptococcique (pour la prévention des crises récurrentes de rhumatisme articulaire aigu).1
Contre-indications
L’érythromycine est contre-indiquée chez les patients présentant une hypersensibilité connue à cet antibiotique.
L’érythromycine est contre-indiquée chez les patients prenant de la terfénadine, de l’astémizole, du pimozide ou du cisapride (voir PRÉCAUTIONS – Interactions médicamenteuses).
Ne pas utiliser l’érythromycine de façon concomitante avec les inhibiteurs de l’HMG CoA réductase (statines) qui sont largement métabolisés par le CYP 3A4 (lovastatine ou simvastatine), en raison du risque accru de myopathie, y compris de rhabdomyolyse.
Avertissements
Hépatotoxicité
On a signalé des cas de dysfonctionnement hépatique, y compris une augmentation des enzymes hépatiques et une hépatite hépatocellulaire et/ou cholestatique, avec ou sans ictère, survenus chez des patients recevant des produits à base d’érythromycine par voie orale.
Longueur de l’intervalle QT
L’érythromycine a été associée à une prolongation de l’intervalle QT et à des cas peu fréquents d’arythmie. Des cas de torsades de pointes ont été spontanément rapportés lors de la surveillance post-marketing chez des patients recevant de l’érythromycine. Des décès ont été rapportés. L’érythromycine doit être évitée chez les patients présentant un allongement connu de l’intervalle QT, chez les patients présentant des conditions proarythmiques continues telles qu’une hypokaliémie ou une hypomagnésémie non corrigée, une bradycardie cliniquement significative et chez les patients recevant des agents antiarythmiques de classe IA (quinidine, procaïnamide) ou de classe III (dofétilide, amiodarone, sotalol). Les patients âgés peuvent être plus sensibles aux effets associés au médicament sur l’intervalle QT.
Syphilis pendant la grossesse
Certains rapports suggèrent que l’érythromycine n’atteint pas le ftus à une concentration suffisante pour prévenir la syphilis congénitale. Les nourrissons nés de femmes traitées pendant la grossesse avec de l’érythromycine par voie orale pour une syphilis précoce doivent être traités avec un régime de pénicilline approprié.
Diarrhée associée à Clostridium difficile
La diarrhée associée à Clostridium difficile (DACD) a été rapportée avec l’utilisation de presque tous les agents antibactériens, y compris E.E.S., et peut varier en gravité de la diarrhée légère à la colite fatale. Le traitement par des agents antibactériens modifie la flore normale du côlon, ce qui entraîne une prolifération de C. difficile.
C. difficile produit des toxines A et B qui contribuent au développement de la DACD. Les souches de C. difficile produisant des hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires à la thérapie antimicrobienne et peuvent nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée après avoir pris des antibiotiques. Des antécédents médicaux minutieux sont nécessaires puisque la DACD a été signalée comme pouvant survenir plus de deux mois après l’administration d’agents antibactériens.
Si la DACD est suspectée ou confirmée, il peut être nécessaire d’interrompre l’utilisation continue d’antibiotiques non dirigés contre C. difficile. Une gestion appropriée des fluides et des électrolytes, une supplémentation en protéines, un traitement antibiotique du C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Interactions médicamenteuses
Des effets indésirables graves ont été rapportés chez des patients prenant de l’érythromycine en concomitance avec des substrats du CYP3A4. Il s’agit notamment de toxicité avec la colchicine, de rhabdomyolyse avec la simvastatine, la lovastatine et l’atorvastatine, et d’hypotension avec les inhibiteurs calciques métabolisés par le CYP3A4 (par ex, vérapamil, amlodipine, diltiazem) (voir PRÉCAUTIONS – Interactions médicamenteuses).
Des rapports de post-commercialisation ont fait état de toxicité de la colchicine lors de l’utilisation concomitante d’érythromycine et de colchicine. Cette interaction est potentiellement mortelle et peut survenir lors de l’utilisation des deux médicaments aux doses recommandées (voir PRÉCAUTIONS – Interactions médicamenteuses).
Des cas de rhabdomyolyse avec ou sans insuffisance rénale ont été rapportés chez des patients gravement malades recevant de l’érythromycine en concomitance avec la lovastatine. Par conséquent, les patients recevant de façon concomitante de la lovastatine et de l’érythromycine doivent faire l’objet d’une surveillance attentive des taux de créatine kinase (CK) et de transaminases sériques. (Voir la notice de la lovastatine.)
Précautions
Généralités
Prescrire l’E.E.S. en l’absence d’une infection bactérienne avérée ou fortement suspectée ou d’une indication prophylactique est peu susceptible d’apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
L’érythromycine étant principalement excrétée par le foie, il convient d’être prudent lorsque l’érythromycine est administrée à des patients présentant une insuffisance hépatique (voir sections PHARMACOLOGIE CLINIQUE et MISES EN GARDE).
Une exacerbation des symptômes de la myasthénie grave et une nouvelle apparition des symptômes du syndrome myasthénique ont été signalées chez des patients recevant un traitement à l’érythromycine.
On a signalé des cas de sténose hypertrophique du pylore infantile (SHPI) survenus chez des nourrissons après un traitement à l’érythromycine. Dans une cohorte de 157 nouveau-nés ayant reçu de l’érythromycine pour la prophylaxie de la coqueluche, sept nouveau-nés (5 %) ont développé des symptômes de vomissements non liquides ou d’irritabilité lors de l’alimentation et ont ensuite été diagnostiqués comme souffrant d’une SHPI nécessitant une pyloromyotomie chirurgicale. Un effet dose-réponse possible a été décrit avec un risque absolu de SPHI de 5,1 % pour les nourrissons qui ont pris de l’érythromycine pendant 8 à 14 jours et de 10 % pour les nourrissons qui ont pris de l’érythromycine pendant 15 à 21 jours.2 Comme l’érythromycine peut être utilisée dans le traitement d’affections chez les nourrissons qui sont associées à une mortalité ou à une morbidité significative (comme la coqueluche ou les infections néonatales à Chlamydia trachomatis), le bénéfice du traitement à l’érythromycine doit être évalué par rapport au risque potentiel de développer un SPHI. Les parents doivent être informés de contacter leur médecin en cas de vomissements ou d’irritabilité lors de l’alimentation.
L’utilisation prolongée ou répétée de l’érythromycine peut entraîner une prolifération de bactéries ou de champignons non sensibles. En cas de surinfection, l’érythromycine doit être interrompue et un traitement approprié doit être instauré.
Lorsqu’ils sont indiqués, l’incision et le drainage ou d’autres procédures chirurgicales doivent être réalisés conjointement avec l’antibiothérapie.
Information pour les patients
Les patients doivent être informés que les médicaments antibactériens, y compris l’E.E.S., ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque l’E.E.S. est prescrit pour traiter une infection bactérienne, il faut dire aux patients que même s’il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l’efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne soient pas traitables par l’E.E.S. ou d’autres médicaments antibactériens à l’avenir.
La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l’antibiotique est arrêté. Parfois, après avoir commencé un traitement par antibiotiques, les patients peuvent avoir des selles liquides et sanglantes (avec ou sans crampes d’estomac et fièvre), même deux mois ou plus après avoir pris la dernière dose de l’antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
Interactions médicamenteuses
Théophylline
L’utilisation de l’érythromycine chez les patients qui reçoivent de fortes doses de théophylline peut être associée à une augmentation des taux sériques de théophylline et à une toxicité potentielle de la théophylline. En cas de toxicité de la théophylline et/ou de taux sériques élevés de théophylline, la dose de théophylline doit être réduite pendant que le patient reçoit un traitement concomitant par érythromycine.
Des rapports publiés suggèrent que lorsque l’érythromycine orale est administrée en même temps que la théophylline, il y a une diminution des concentrations sériques d’érythromycine d’environ 35 %. Le mécanisme par lequel cette interaction se produit est inconnu. La diminution des concentrations d’érythromycine due à l’administration concomitante de théophylline pourrait entraîner des concentrations subthérapeutiques d’érythromycine.
Vérapamil
Des cas d’hypotension, de bradyarythmie et d’acidose lactique ont été observés chez des patients recevant simultanément du vérapamil, appartenant à la classe médicamenteuse des inhibiteurs calciques.
Digoxine
L’administration concomitante d’érythromycine et de digoxine a été signalée comme entraînant une élévation des taux sériques de digoxine.
Anticoagulants
On a signalé une augmentation des effets anticoagulants lors de l’utilisation concomitante d’érythromycine et d’anticoagulants oraux. L’augmentation des effets anticoagulants due aux interactions de l’érythromycine avec divers anticoagulants oraux peut être plus prononcée chez les personnes âgées.
L’érythromycine est un substrat et un inhibiteur de la sous-famille de l’isoforme 3A du système enzymatique du cytochrome p450 (CYP3A). L’administration concomitante d’érythromycine et d’un médicament principalement métabolisé par le CYP3A peut être associée à des élévations des concentrations du médicament qui pourraient augmenter ou prolonger les effets thérapeutiques et indésirables du médicament concomitant. Des ajustements posologiques peuvent être envisagés et, lorsque cela est possible, les concentrations sériques des médicaments principalement métabolisés par le CYP3A doivent être étroitement surveillées chez les patients recevant simultanément de l’érythromycine.
Voici des exemples de certaines interactions médicamenteuses cliniquement significatives basées sur le CYP3A. Des interactions avec d’autres médicaments métabolisés par l’isoforme CYP3A sont également possibles. Les interactions médicamenteuses suivantes basées sur le CYP3A ont été observées avec des produits à base d’érythromycine dans le cadre de l’expérience de post-commercialisation :
Ergotamine/dihydroergotamine
Les rapports de post-commercialisation indiquent que la coadministration d’érythromycine avec de l’ergotamine ou de la dihydroergotamine a été associée à une toxicité aiguë de l’ergot caractérisée par un vasospasme et une ischémie des extrémités et d’autres tissus, y compris le système nerveux central. L’administration concomitante d’érythromycine et d’ergotamine ou de dihydroergotamine est contre-indiquée (voir CONTRE-INDICATIONS).
Triazolobenzodiazépines (telles que le triazolam et l’alprazolam) et benzodiazépines apparentées
L’érythromycine a été rapportée comme diminuant la clairance du triazolam et du midazolam, et ainsi, peut augmenter l’effet pharmacologique de ces benzodiazépines.
Inhibiteurs de l’HMG-CoA réductase
On a signalé que l’érythromycine augmente les concentrations des inhibiteurs de l’HMG-CoA réductase (par ex, lovastatine et simvastatine). De rares cas de rhabdomyolyse ont été rapportés chez des patients prenant ces médicaments de façon concomitante.
Sildénafil (Viagra)
L’érythromycine a été rapportée comme augmentant l’exposition systémique (ASC) du sildénafil. Une réduction de la posologie du sildénafil doit être envisagée. (Voir la notice de Viagra.)
Il existe des rapports spontanés ou publiés d’interactions basées sur le CYP3A de l’érythromycine avec la ciclosporine, la carbamazépine, le tacrolimus, l’alfentanil, le disopyramide, la rifabutine, la quinidine, la méthylprednisolone, le cilostazol, la vinblastine et la bromocriptine.
L’administration concomitante d’érythromycine et de cisapride, de pimozide, d’astémizole ou de terfénadine est contre-indiquée (voir CONTRE-INDICATIONS).
En outre, on a signalé des interactions de l’érythromycine avec des médicaments dont on ne pense pas qu’ils soient métabolisés par le CYP3A, notamment l’hexobarbital, la phénytoïne et le valproate.
On a signalé que l’érythromycine modifie de façon significative le métabolisme des antihistaminiques non sédatifs terfénadine et astémizole lorsqu’ils sont pris de façon concomitante. De rares cas d’effets indésirables cardiovasculaires graves, y compris un allongement électrocardiographique de l’intervalle QT/QTc, un arrêt cardiaque, des torsades de pointes et d’autres arythmies ventriculaires, ont été observés (voir CONTRE-INDICATIONS). De plus, des décès ont été signalés dans de rares cas lors de l’administration concomitante de terfénadine et d’érythromycine.
On a signalé, depuis la commercialisation, des interactions médicamenteuses lorsque l’érythromycine est administrée en même temps que le cisapride, entraînant un allongement de l’intervalle QT, des arythmies cardiaques, une tachycardie ventriculaire, une fibrillation ventriculaire et des torsades de pointes, très probablement en raison de l’inhibition du métabolisme hépatique du cisapride par l’érythromycine. Des cas de décès ont été rapportés (voir CONTRE-INDICATIONS).
Colchicine
La colchicine est un substrat à la fois du CYP3A4 et du transporteur d’efflux P-glycoprotéine (P-gp). L’érythromycine est considérée comme un inhibiteur modéré du CYP3A4. Une augmentation significative de la concentration plasmatique de colchicine est attendue en cas d’administration concomitante avec des inhibiteurs modérés du CYP3A4 tels que l’érythromycine. Si l’administration conjointe de colchicine et d’érythromycine est nécessaire, la dose initiale de colchicine devra peut-être être réduite, et la dose maximale de colchicine devra être diminuée. Les patients doivent être surveillés à la recherche de symptômes cliniques de toxicité de la colchicine (voir rubrique Mises en garde).
Interactions médicamenteuses/essais de laboratoire
L’érythromycine interfère avec le dosage fluorométrique des catécholamines urinaires.
Carcinogenèse, mutagenèse, altération de la fertilité
Les études alimentaires à long terme par voie orale menées avec le stéarate d’érythromycine chez le rat jusqu’à 400 mg/kg/jour et chez la souris jusqu’à environ 500 mg/kg/jour (environ 1 à 2 fois la dose maximale humaine sur la base de la surface corporelle) n’ont pas apporté de preuve de tumorigénicité. Le stéarate d’érythromycine n’a pas montré de potentiel génotoxique dans les tests d’Ames et de lymphome de souris, ni induit d’aberrations chromosomiques dans les cellules CHO. Il n’y a pas eu d’effet apparent sur la fertilité des mâles ou des femelles chez les rats traités avec la base d’érythromycine par gavage oral à 700 mg/kg/jour (environ 3 fois la dose maximale humaine sur la base de la surface corporelle).
Grossesse
Effets tératogènes
Il n’y a aucune preuve de tératogénicité ou de tout autre effet indésirable sur la reproduction chez les rats femelles nourris à l’érythromycine base par gavage oral à 350 mg/kg/jour (environ deux fois la dose maximale recommandée chez l’homme sur une base de surface corporelle) avant et pendant l’accouplement, pendant la gestation et jusqu’au sevrage.
Aucun signe de tératogénicité ou d’embryotoxicité n’a été observé lorsque l’érythromycine base a été administrée par gavage oral à des rates et des souris gravides à 700 mg/kg/jour et à des lapines gravides à 125 mg/kg/jour (environ 1 à 3 fois la dose maximale recommandée chez l’homme).
L’accouchement
L’effet de l’érythromycine sur le travail et l’accouchement est inconnu.
Mères allaitantes
L’érythromycine est excrétée dans le lait maternel. La prudence s’impose lorsque l’érythromycine est administrée à une femme qui allaite.
Utilisation pédiatrique
Voir les sections INDICATIONS ET USAGE et POSOLOGIE ET ADMINISTRATION.
Utilisation gériatrique
Les patients âgés, en particulier ceux dont la fonction rénale ou hépatique est réduite, peuvent présenter un risque accru de développer une perte auditive induite par l’érythromycine (voir les sections EFFETS INDÉSIRABLES et POSOLOGIE ET ADMINISTRATION).
Les patients âgés peuvent être plus susceptibles de développer des arythmies à torsades de pointes que les patients plus jeunes (voir MISES EN GARDE).
Les patients âgés peuvent subir des effets accrus d’un traitement anticoagulant oral lorsqu’ils sont sous traitement par l’érythromycine (voir PRÉCAUTIONS – Interactions médicamenteuses).
Les granulés E.E.S.® contiennent 25,9 mg (1,1 mEq) de sodium par dose individuelle.
La population gériatrique peut répondre par une natriurèse émoussée à la charge en sel. Ceci peut être cliniquement important en ce qui concerne des maladies telles que l’insuffisance cardiaque congestive.
E.E.S. 400 pelliculé contient 47 mg (2 mEq) de sodium par comprimé et 10,0 mg (0,3 mEq) de potassium par comprimé.
Réactions indésirables
Les effets secondaires les plus fréquents des préparations orales d’érythromycine sont gastro-intestinaux et sont liés à la dose. Ils comprennent les nausées, les vomissements, les douleurs abdominales, la diarrhée et l’anorexie. Des symptômes d’hépatite, un dysfonctionnement hépatique et/ou des résultats anormaux des tests de la fonction hépatique peuvent survenir (voir section MISES EN GARDE).
L’apparition des symptômes de colite pseudo-membraneuse peut survenir pendant ou après un traitement antibactérien (voir section MISES EN GARDE).
L’érythromycine a été associée à un allongement de l’intervalle QT et à des arythmies ventriculaires, notamment une tachycardie ventriculaire et des torsades de pointes (voir rubrique MISES EN GARDE).
Des réactions allergiques allant de l’urticaire à l’anaphylaxie sont survenues. Des réactions cutanées allant d’éruptions légères à l’érythème polymorphe, au syndrome de Stevens-Johnson et à la nécrolyse épidermique toxique ont été signalées dans de rares cas.
On a signalé des cas de néphrite interstitielle coïncidant avec l’utilisation de l’érythromycine.
On a signalé de rares cas de pancréatite et de convulsions.
Il y a eu des rapports isolés de perte auditive réversible survenant principalement chez des patients souffrant d’insuffisance rénale et chez des patients recevant de fortes doses d’érythromycine.
Surdosage
En cas de surdosage, l’érythromycine doit être arrêtée. Le surdosage doit être traité par l’élimination rapide du médicament non absorbé et toutes les autres mesures appropriées doivent être instituées.
L’érythromycine n’est pas éliminée par dialyse péritonéale ou hémodialyse.
EES Posologie et mode d’administration
Les suspensions d’éthylsuccinate d’érythromycine et les comprimés pelliculés peuvent être administrés sans tenir compte des repas.
Enfants
L’âge, le poids et la gravité de l’infection sont des facteurs importants pour déterminer la posologie adéquate. Dans les infections légères à modérées, la posologie habituelle de l’éthylsuccinate d’érythromycine pour les enfants est de 30 à 50 mg/kg/jour en doses également réparties toutes les 6 heures. Pour les infections plus sévères, cette posologie peut être doublée. Si une posologie biquotidienne est souhaitée, la moitié de la dose quotidienne totale peut être administrée toutes les 12 heures. Les doses peuvent également être administrées trois fois par jour en administrant un tiers de la dose quotidienne totale toutes les 8 heures.
Le schéma posologique suivant est suggéré pour les infections légères à modérées :
| Poids corporel | Dose quotidienne totale |
|---|---|
| Moins de 10 lb | 30 à 50 mg/kg/jour 15 à 25 mg/lb/jour |
| 10 à 15 lbs | 200 mg |
| 16 à 25 lbs | 400 mg |
| 26 à 50 lbs | 800 mg |
| 51 à 100 lbs | 1200 mg |
| plus de 100 lbs | 1600 mg |
Adultes
400 mg d’éthylsuccinate d’érythromycine toutes les 6 heures est la dose habituelle. La posologie peut être augmentée jusqu’à 4 g par jour en fonction de la sévérité de l’infection. Si une posologie biquotidienne est souhaitée, la moitié de la dose quotidienne totale peut être administrée toutes les 12 heures. Les doses peuvent également être administrées trois fois par jour en administrant un tiers de la dose quotidienne totale toutes les 8 heures.
Pour le calcul de la posologie chez l’adulte, utiliser un rapport de 400 mg d’activité d’érythromycine sous forme d’éthylsuccinate pour 250 mg d’activité d’érythromycine sous forme de stéarate, de base ou d’estolate.
Dans le traitement des infections streptococciques, une posologie thérapeutique d’éthylsuccinate d’érythromycine doit être administrée pendant au moins 10 jours. En prophylaxie continue contre les récidives d’infections streptococciques chez les personnes ayant des antécédents de cardiopathie rhumatismale, la posologie habituelle est de 400 mg deux fois par jour.
Pour le traitement de l’urétrite due à C. trachomatis ou U. urealyticum
800 mg trois fois par jour pendant 7 jours.
Pour le traitement de la syphilis primaire
Adultes
48 à 64 g administrés en doses fractionnées sur une période de 10 à 15 jours.
Pour l’amibiase intestinale
Adultes
400 mg quatre fois par jour pendant 10 à 14 jours.
Enfants
30 à 50 mg/kg/jour en doses fractionnées pendant 10 à 14 jours.
Pour utilisation dans la coqueluche
Bien que la posologie et la durée optimales n’aient pas été établies, les doses d’érythromycine utilisées dans les études cliniques rapportées étaient de 40 à 50 mg/kg/jour, administrées en doses fractionnées pendant 5 à 14 jours.
Pour le traitement de la maladie du légionnaire
Bien que les doses optimales n’aient pas été établies, les doses utilisées dans les données cliniques rapportées étaient celles recommandées ci-dessus (1,6 à 4 g par jour en doses fractionnées).
Directions pour mélanger les granules E.E.S.
100 mL
Ajouter 77 mL d’eau et agiter vigoureusement. Cela donne 100 mL de suspension.
200 mL
Ajouter 154 mL d’eau et agiter vigoureusement. Cela donne 200 mL de suspension.
Comment la S.E.E. est-elle fournie
Les granules de S.E.E. 200 mg par 5 mL (éthylsuccinate d’érythromycine pour suspension orale, USP) sont des granules roses avec un arôme de cerise et sont fournis en flacons de 100 mL (NDC 24338-134-02) et 200 mL (NDC 24338-136-10). Après reconstitution, les granulés E.E.S. deviennent une suspension rose opaque avec un arôme de cerise.
E.E.S. 400 comprimés pelliculés (comprimés d’éthylsuccinate d’érythromycine, USP) 400 mg, sont fournis sous forme de comprimés ovales roses imprimés avec la désignation à deux lettres, EE, dans :
Flacons de 30 (NDC 24338-100-03) Flacons de 100 (NDC 24338-100-13)
Conservation recommandée
Stocker entre 20° et 25°C (68° et 77°F) .
Stocker les granules, avant le mélange, entre 20° et 25°C (68° et 77°F) . Après mélange, réfrigérer et utiliser dans les 10 jours.
- Commission sur le rhumatisme articulaire aigu, l’endocardite et la maladie de Kawasaki du Conseil sur les maladies cardiovasculaires chez les jeunes, l’American Heart Association : Prévention du rhumatisme articulaire aigu. Circulation. 78(4):1082-1086, octobre 1988.
- Honein, M.A., et al : Sténose pylorique hypertrophique infantile après la prophylaxie de la coqueluche avec l’érythromycine : une revue de cas et une étude de cohorte. The Lancet 1999:354 (9196) : 2101-5.
Révisé : Avril 2018
EES-PI-03
Arbor Pharmaceuticals, LLC
Atlanta, GA 30328
(Nos. 5729, 6369)
Panneau d’affichage principal – Étiquette du flacon de comprimés de 400 mg
NDC 24338-100-03
30 comprimés
E.E.S. 400®
Comprimés pelliculés
ERYTHROMYCINE
ETHYLSUCCINATE
Comprimés, USP
400 mg
Erythromycine
activité
Rx only
arbor
PHARMACEUTICALS, LLC

Panneau d’affichage principal – Étiquette de bouteille de 100 mL
NDC 24338-134-02
100 mL (une fois mélangé)
Pour suspension orale
E.E.S.® Granules
ERYTHROMYCINE
ETHYLSUCCINATE POUR
SUSPENSION ORALE, USP
Activité de l’érythromycine
200 mg par 5 mL
lorsque reconstitué
Rx seulement
arbor®
PHARMACEUTICALS, INC.

Panneau d’affichage principal – Étiquette de flacon de 5 mL
NDC 24338-136-10
200 mL (une fois mélangé)
Pour suspension orale
E.E.S.® Granules
ERYTHROMYCINE
ETHYLSUCCINATE POUR
SUSPENSION ORALE, USP
Activité érythromycine
200 mg par 5 mL
lorsque reconstitué
Rx only
arbor®
PHARMACEUTICALS, INC.

| E.E.S 400 Comprimé d’éthylsuccinate d’érythromycine |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
| E.E.S Granule d’éthylsuccinate d’érythromycine, pour suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| E.E.S Granule d’éthylsuccinate d’érythromycine, pour suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
Étiqueteur – Arbor Pharmaceuticals, Inc. (781796417)
Frequently asked questions
- Peut-on prendre des antibiotiques pendant la grossesse ?
Plus d’informations sur E.E.S. Granules (érythromycine)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Information sur la posologie
- Interactions médicamenteuses
- Prix & Coupons
- En Español
- Classe de médicaments : macrolides
Ressources pour le consommateur
- Lecture avancée
Ressources professionnelles
- Informations sur la prescription
- Comprimés d’érythromycine (FDA)
Autres marques Ery-Tab, EryPed, Erythrocine, Eryc, PCE Dispertab
Guides de traitement associés
- Prévention de l’endocardite bactérienne
- Bartonellose
- Préparation de l’intestin
- Bronchite
- … +21 more
Avis médical