
Molekulare Dimere werden oft durch die Reaktion zweier identischer Verbindungen gebildet, z. B.: 2A → A-A. In diesem Beispiel wird gesagt, dass das Monomer „A“ dimerisiert und das Dimer „A-A“ entsteht. Ein Beispiel ist ein Diaminocarben, das zu einem Tetraaminoethylen dimerisiert:
2 C(NR2)2 → (R2N)2C=C(NR2)2
Carbene sind sehr reaktiv und bilden leicht Bindungen.
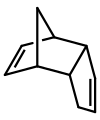
Dicyclopentadien ist ein asymmetrisches Dimer zweier Cyclopentadienmoleküle, die in einer Diels-Alder-Reaktion zu dem Produkt reagiert haben. Beim Erhitzen „spaltet“ es sich (durchläuft eine Retro-Diels-Alder-Reaktion) und es entstehen identische Monomere:
C10H12 → 2 C5H6
Viele nichtmetallische Elemente treten als Dimere auf: Wasserstoff, Stickstoff, Sauerstoff, die Halogene, d. h. Fluor, Chlor, Brom und Jod. Edelgase können Dimere bilden, die durch Van-der-Waals-Bindungen verbunden sind, z. B. Dihelium oder Diargon. Quecksilber kommt als Quecksilber(I)-Kation (Hg22+) vor, formal ein dimeres Ion. Andere Metalle können in ihrem Dampf einen Anteil an Dimeren bilden. Bekannte metallische Dimere sind Li2, Na2, K2, Rb2 und Cs2.
Viele kleine organische Moleküle, vor allem Formaldehyd, bilden leicht Dimere. Das Dimer von Formaldehyd (CH2O) ist Dioxetan (C2H4O2).