1. Durchlässigkeit
2. Flüssigkeit
3. Heterogenität
– Inneres
– Äußeres
– Biegung, Dicke
Die Funktionen der Zellmembranen werden durch ihre molekulare Zusammensetzung bestimmt. Die Art und der Anteil dieser Moleküle bestimmen die physikalisch-chemischen Eigenschaften der Membran: Semipermeabilität, Asymmetrie, Fluidität, Reparatur und Recycling.
Permeabilität
Die Semipermeabilität der Membranen ist eine Folge der internen hydrophoben Umgebung der Membranen, die durch die Fettsäureketten der Lipide geschaffen wird und die von Molekülen mit elektrischen Ladungen nur schwer durchquert werden kann. Indem sie die freie Diffusion von Molekülen verhindern, können Membranen also Kompartimente bilden, die eine getrennte innere und äußere Umgebung bewahren. Die Durchlässigkeit ist jedoch selektiv. Polarität und Größe sind die wichtigsten molekularen Merkmale, die die Fähigkeit, Membranen zu passieren, beeinflussen. Kleine Moleküle ohne elektrische Ladung wie CO2, N2, O2 und Moleküle mit hoher Fettlöslichkeit wie Ethanol können Membranen durch passive Diffusion fast ungehindert passieren (Abbildung 1). Die Durchlässigkeit ist bei elektrisch geladenen Molekülen geringer, wenn die Anzahl der positiven Ladungen die der negativen Ladungen übersteigt, d. h. bei ungeladenen Molekülen wie Wasser und Glycerin. Man könnte meinen, dass Wasser die Membranen ungehindert durchqueren kann, aber es gibt einige Einschränkungen, und deshalb enthalten einige Membranen Aquaporine, eine Art Transmembranprotein mit einem Kanal, der das Wasser ungehindert durchlässt. Die Fähigkeit großer ungeladener Moleküle wie Glukose, Membranen zu durchqueren, ist gering. Membranen sind für Ionen und geladene Moleküle sehr undurchlässig. Einige Werte für den Permeabilitätskoeffizienten durch passive Diffusion sind: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, Glycerin: 10 -6 cm/s, Natrium und Kalium: 10 -14 cm/s.
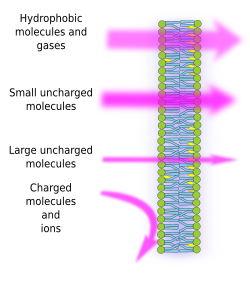
Die ungleiche Verteilung von Ionen und Molekülen zwischen den beiden Seiten einer Membran ermöglicht die Erzeugung und Aufrechterhaltung elektrochemischer Gradienten. Die Differenz zwischen der inneren und der äußeren Konzentration elektrischer Ladungen wird als Membranpotential bezeichnet. Dieser Gradient wird für viele Zellfunktionen genutzt, z. B. für die ATP-Synthese und die Übertragung von Informationen über die Nerven. Die Semipermeabilität ist auch für osmotische Prozesse verantwortlich, d. h. Wasserbewegungen durch die Membranen von einer weniger konzentrierten Lösung auf der einen Seite zu einer konzentrierteren Lösung auf der anderen Seite, um beide Konzentrationen auszugleichen. Auf diese Weise können Pflanzenzellen dank einer höheren intrazellulären Konzentration bestimmter gelöster Stoffe, die das Eindringen von Wasser in die Zelle bewirken, an Größe zunehmen, was wiederum einen inneren hydrostatischen Druck (den so genannten Turgordruck) erzeugt, der die Zellwände nach außen drückt. Moleküle, die die Membranen nicht ungehindert durchqueren können, sind für die Zellen nützlich, weil sie Gradienten erzeugen können, die als Informationsmechanismen oder als Energiespeicher dienen können. Zellen verfügen über Transmembranproteine, die es ermöglichen, die Membran zu durchqueren oder geladene Moleküle und Ionen zwischen den beiden Seiten der Zellmembranen zu bewegen, wobei die hydrophobe Umgebung der inneren Membran vermieden wird. So wird beispielsweise eine Muskelkontraktion durch die Öffnung von Kanälen ausgelöst, die einen bestehenden Ionengradienten verringern.
Die Semipermeabilität wird durch die Lipidzusammensetzung der Membranen beeinflusst. Zum Beispiel ist der Cholesteringehalt in der Plasmamembran wichtig. Ein Anstieg des Cholesteringehalts verringert die Fluidität und erhöht die Hydrophobie, beides Eigenschaften, die die Membran undurchlässiger machen. So macht die Erhöhung des Cholesteringehalts über 30 % (was ein hoher Wert ist) Myelinmembranen sehr geeignet für die Isolierung der Axone und die Optimierung der Ausbreitung des Aktionspotentials entlang des Axons.
Fluidität und laterale Domänen
Fluidität ist eine Eigenschaft von Membranen. Sie bezieht sich auf die Fähigkeit der Moleküle, sich innerhalb der Membranen zu bewegen. Eine höhere Fluidität bedeutet, dass die Bewegungen häufiger sind. Zellmembranen sind eigentlich eine Fettschicht, in der sich die Moleküle in einem halbflüssigen, viskosen Zustand befinden. Daher kann man davon ausgehen, dass sich Moleküle durch Diffusion bewegen können. Ein Glycerophospholipid, das sich in der äußeren Monoschicht der Plasmamembran befindet, kann sich beispielsweise auf zwei Arten bewegen: lateral, d. h. in derselben Monoschicht, und flip-flop, d. h. von einer Monoschicht zur anderen springen (Abbildung 2). In künstlichen Membranen wurden diese beiden Arten von Bewegungen beobachtet, wobei die lateralen Bewegungen viel häufiger sind als die Flip-Flop-Bewegungen. Durch laterale Diffusion können Lipide 30 µm in 20 Sekunden zurücklegen; sie können den gesamten Umfang einer mittelgroßen Zelle in einer Minute durchqueren. Flip-Flop-Bewegungen sind jedoch sehr selten, da der hydrophile Kopf des Lipidmoleküls die innere Schicht der Fettsäureketten durchqueren muss, was thermodynamisch schwierig ist. Bei einem Lipidmolekül liegt die Wahrscheinlichkeit einer Flip-Flop-Bewegung bei etwa einem Mal pro Monat. Cholesterin verhält sich jedoch anders und kann ziemlich leicht flip-flop machen.

Die Membranfluidität kann sich je nach chemischer Zusammensetzung ändern. Im Allgemeinen erhöhen kürzere Fettsäureketten und ein höherer Anteil an ungesättigten Bindungen zwischen den Kohlenstoffen der Fettsäuren die Membranfluidität. Die Menge an Cholesterin beeinflusst ebenfalls die Membranfluidität, aber der Nettoeffekt hängt von der Temperatur und der Art der Lipide in der Membran ab. Cholesterin hat zwei Auswirkungen: Es hemmt den Übergang in einen festen Gelzustand (geringere Fluidität), verringert aber auch die Flexibilität der ungesättigten Fettsäureketten. Generell kann man sagen, dass ein Anstieg der Cholesterinkonzentration die Membranfluidität verringert, obwohl bei niedrigen Temperaturen die Wirkung umgekehrt ist. Interne Membranen der Zelle, wie die des endoplasmatischen Retikulums, enthalten sehr wenig Cholesterin und sind daher flüssiger. Darüber hinaus verleiht Cholesterin den Membranen eine weitere Eigenschaft, die als Hidrophobie bezeichnet wird und die Membranen undurchlässiger macht.
Die unterschiedliche molekulare Zusammensetzung der beiden Monoschichten einer Membran, die so genannte Membranasymmetrie, kann in jeder Monoschicht eine unterschiedliche Fluidität erzeugen. Je nach molekularer Zusammensetzung können Lipide in zwei physikalischen Phasen vorliegen: flüssig-geordnet (weniger Fluidität) und flüssig-ungeordnet (mehr Fluidität). Die äußere Monoschicht der Plasmamembran befindet sich vermutlich häufiger in der flüssig-geordneten Phase, während die innere Monoschicht eher in der flüssig-ungeordneten Phase ist.
Zellen können die Fluidität der Membranen durch Veränderung ihrer chemischen Zusammensetzung modifizieren. Zum Beispiel passen Bakterien die Sättigung und Länge der Fettsäureketten an, so dass die Membranfluidität an die Umweltbedingungen angepasst werden kann. Auch eine Veränderung der Konzentration von Glycerophospholipiden wie Phosphatidylethanolamin kann die Fluidität beeinflussen. Einige Insekten können keine Sterole wie Cholesterin synthetisieren, und die Sterole ihrer Membranen stammen aus der Nahrung. Sie verändern die Fluidität ihrer Zellmembranen durch unterschiedliche Konzentrationen von Phosphatidylethanolamin.
Die innere Membran der Mitochondrien muss eine starke undurchlässige Barriere sein, um einen Protonengradienten zu erzeugen und aufrechtzuerhalten. Dies könnte durch eine Erhöhung des Cholesteringehalts erreicht werden. Auf diese Weise wird zwar die Hidrophobie erhöht, aber im Gegenzug verringert Cholesterin die Fluidität, die für die Funktion der Proteine in dieser Membran sehr wichtig zu sein scheint. Mitochondrien lösen das Problem mit Cardiolipin, einem ungesättigten Phospholipid, das die Hidrophobie erhöht, aber die Membranfluidität nicht wesentlich verringert.
3. Heterogenität
Aufgrund der Fluidität könnte man annehmen, dass die Proteine zufällig verteilt sind und die Membranen daher hinsichtlich der molekularen Zusammensetzung homogen sind, d.h. sie weisen unabhängig von der Membranregion den gleichen molekularen Gehalt und Anteil auf. Dies ist jedoch nicht der Fall. Es gibt Einschränkungen für die laterale Diffusion von Molekülen, die zu einer Heterogenität der Membran führen, was bedeutet, dass es Bereiche einer Membran mit unterschiedlicher molekularer Zusammensetzung gibt. In nicht polarisierten Zellen und bei einer Größe von mehr als 200 nm sieht die Plasmamembran homogen aus, aber bei einer Größe von weniger als 200 nm ist sie heterogen. Man nimmt an, dass die Mikrodomänen von Membranen etwa 60 µm groß sind. Lipide und Proteine zeigen seitliche Bewegungen, die meist auf Bereiche von 60 bis 200 nm beschränkt sind, und springen dann in einen anderen, angrenzenden Bereich, wo sie für eine weitere kurze Zeit verbleiben. Dieses Verhalten wird als saltatorische Diffusion bezeichnet.
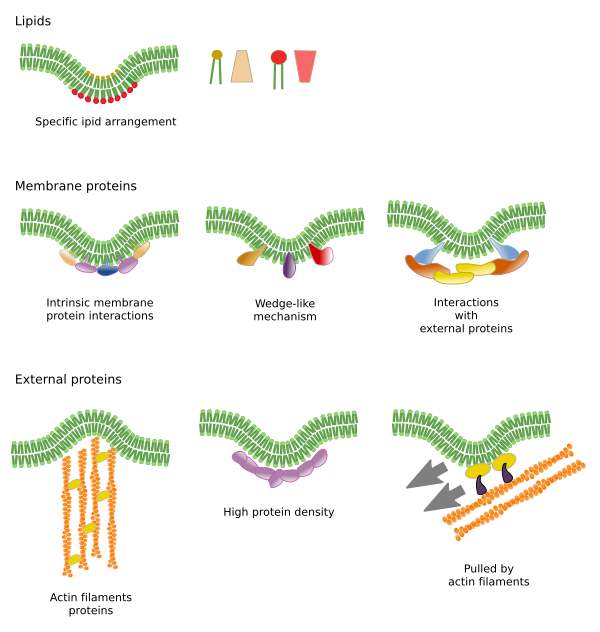
Einschränkungen der lateralen Bewegungen von Molekülen können durch verschiedene Mechanismen verursacht werden: Wechselwirkungen mit dem Zytoskelett oder der extrazellulären Matrix, Wechselwirkungen der Membranmoleküle untereinander, unterschiedliche Dichten lokaler Membranbereiche (Veränderungen der Fluidität), die Menge elektrischer Ladungen, die Krümmung der Membran und die unterschiedliche Dicke der Membrandomänen (Abbildung 3).
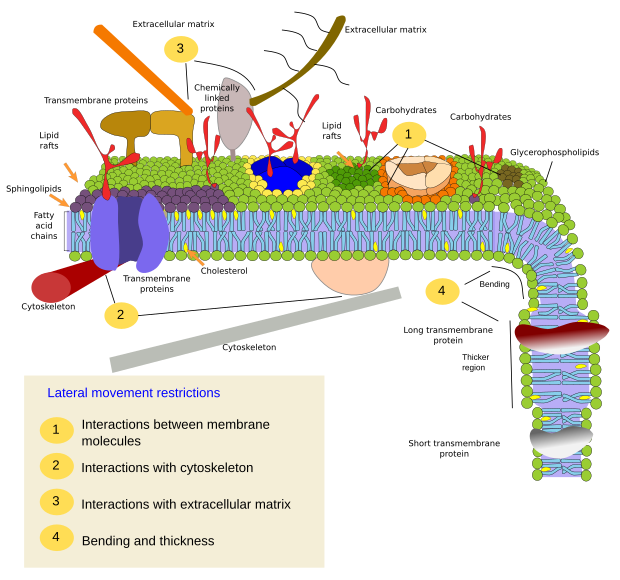
Interne Wechselwirkungen
Wechselwirkungen der Membranmoleküle untereinander schränken die laterale Bewegung ein. Sowohl die Bewegungen der Proteine als auch der Lipide werden durch diese Wechselwirkungen beeinflusst, was zur Bildung von Mikrodomänen mit unterschiedlicher molekularer Zusammensetzung führt (Abbildung 4). Das Ergebnis ist eine heterogene laterale Verteilung der Moleküle in den Membranen. Je nach den molekularen Verhältnissen können die Lipid-Mikrodomänen eine unterschiedliche Dichte (d. h. Fluidität) aufweisen: fest, flüssig geordnet und flüssig ungeordnet. Die häufigste Dichte ist „liquid disordered“ (flüssig ungeordnet), die am flüssigsten ist.
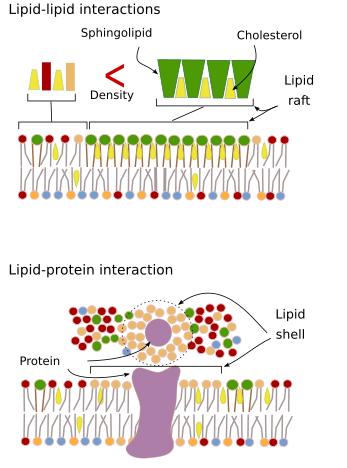
Sphingolipide und Cholesterin können spontan miteinander assoziiert werden, was ihre Beweglichkeit verringert und die molekulare Dichte im Vergleich zu benachbarten Bereichen erhöht. Es bildet sich eine kleine Gruppe von Molekülen, die wie ein Floß in einem Meer von Lipiden schwimmt. Diese molekularen Assoziationen sind als Lipid Rafts bekannt, und man nimmt an, dass sie sehr häufig in Zellmembranen vorkommen. Lipid-Flöße zeigen ein sehr dynamisches Verhalten, sie können sich bewegen, wachsen, sich verkleinern, erscheinen und verschwinden. In der Tat bestehen die Membranen aus vielen dichten Domänen, die sich seitlich zwischen den Glycerophospholipiden bewegen, so dass die Membranen hinsichtlich ihrer molekularen Verteilung recht heterogen sind. Einige Experimente deuten darauf hin, dass sich bestimmte Arten von Proteinen in Lipid Rafts wohler fühlen. Diese Proteine verbringen mehr Zeit innerhalb als außerhalb der Lipid Rafts, so dass sie sich eine Zeit lang innerhalb dieser Dichten bewegen. Dies führt zu einer Entmischung der Moleküle entlang der Membran und erhöht die Wahrscheinlichkeit, dass sich verschiedene Moleküle länger als nur zufällig in der Nähe befinden (Diffusion), wodurch sich die Wahrscheinlichkeit bestimmter molekularer Reaktionen erhöht. Darüber hinaus wird vermutet, dass eine hohe Konzentration bestimmter Lipidarten in den Lipid Rafts eine besondere chemische Umgebung schafft, die bestimmte chemische Reaktionen oder molekulare Wechselwirkungen erleichtert. Es wurde vorgeschlagen, dass Lipid Rafts in der äußeren Monoschicht der Plasmamembran vorhanden sind, weil dort Sphingolipide im Überfluss vorhanden sind. Es wird angenommen, dass auch in den Membranen von Organellen Membrandomänen vorhanden sind und dass einige ihrer Funktionen von diesen Membrandomänen abhängen.
In der inneren Monolage der Plasmamembran werden Mikrodomänen durch elektrostatische Wechselwirkungen zwischen basischen zytosolischen Domänen oder Domänen von Proteinen mit zweiwertigen Kationen und den negativen polaren Köpfen von Lipiden gebildet. Ein weiteres, weniger bekanntes Beispiel ist die Assoziation zwischen Phosphatidylinositolbisphosphat und Cholesterin, die Mikrodomänen in dieser Monolage bildet. Diese Mikrodomänen, die dem Zytosol zugewandt sind, können intrazelluläre Proteingerüste beeinflussen.
Bisher ging man davon aus, dass es keine Wechselwirkungen zwischen den beiden Membranmonolagen gibt und dass sie ihre Mikrodomänen unabhängig voneinander verteilen. Es gibt jedoch Hinweise darauf, dass es Wechselwirkungen zwischen ihnen gibt. Transmembranproteine wirken gleichzeitig auf beide Monoschichten, da sie die gesamte Membran durchqueren. Eine andere Art der Synchronisation zwischen den beiden Monolayern kann durch lange Fettsäureketten vermittelt werden, wie z. B. bei einigen Sphingolipiden, die bis zu 24 Kohlenstoffe lang sein können (die normale Länge beträgt 18). Diese langen Ketten können sich zwischen den Fettsäureketten der Lipide der anderen Monoschicht einfügen und die Lipidverteilung beeinflussen. Außerdem wird angenommen, dass Lipiddomänen mit langen Fettsäureketten durch Lipidmikrodomänen mit kurzen Fettsäureketten in der anderen Monoschicht ausgeglichen werden, wodurch die Dicke der Membran konstant gehalten wird.
Membranproteine, sowohl integrale als auch assoziierte, können auch untereinander interagieren und sich zu makromolekularen Gerüsten zusammenfügen, um die Informationsübertragung, die Zell-Zell-Erkennung, den Start einiger enzymatischer Aktivitäten und die zelluläre Bewegung zu erleichtern. Es gibt auch multimere Proteine, die nur aktiv sind, wenn alle Untereinheiten zusammengehalten werden. Der Insulinrezeptor zum Beispiel besteht aus vier Untereinheiten. Proteine und Lipide können auch zusammenwirken, um Membrandomänen zu bilden. In der inneren Monoschicht verbinden sich beispielsweise Phosphatidylinositol und Proteine durch elektrische Wechselwirkungen, die durch Modifizierung der Phosphate am polaren Kopf der Lipide reguliert werden können.
Interaktionen mit äußeren Elementen
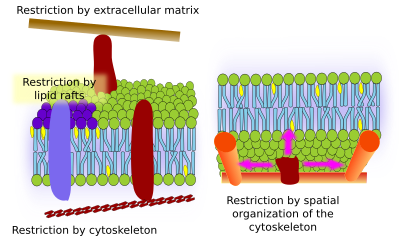
Integrale Membranproteine können sich ebenfalls seitlich bewegen, sind aber stärker eingeschränkt als Lipide, vor allem aufgrund von Wechselwirkungen mit der extrazellulären Matrix und dem Zytoskelett über ihre extrazellulären bzw. intrazellulären Domänen (Abbildung 5). Diese Wechselwirkungen können dazu führen, dass Proteine länger als nur durch Diffusion in kleinen Bereichen der Membran verbleiben. Das Zytoskelett kann direkt unter der Plasmamembran Zäune bilden, die die Proteine auf kleine Bereiche beschränken. Aktinfilamente und Mikrotubuli können kleine Bereiche umschließen, die die Diffusion von Proteinen und Lipiden einschränken. Wechselwirkungen mit dem Zytoskelett sind wichtig, denn wenn das Zytoskelett experimentell desorganisiert ist, wird die Membran wesentlich homogener. Zellen verfügen über andere Mechanismen, um Proteine auf bestimmte Bereiche zu beschränken. So sind beispielsweise in Darmepithelzellen einige Transporter und Enzyme in der apikalen Plasmamembran, nicht aber in der basolateralen Domäne angesiedelt, weil ein Gürtel aus Tight Junctions, einem molekularen Reißverschluss, die Diffusion zwischen der apikalen und der basolateralen Domäne verhindert. Diese asymmetrische Verteilung ist für die Physiologie der Epithelzelle wesentlich.
Die Biegung der Membran ist eine weitere Möglichkeit, Mikrodomänen zu schaffen. Eine Membrankrümmung kann der Ausgangspunkt für die Bildung eines Vesikels, einer Zytoplasmaerweiterung für die Zellexpansion, einer Formveränderung oder des Wachstums einer Organelle oder einfach nur für eine Barriere zur Einschränkung der seitlichen Bewegung von Molekülen sein. Dies ist eine physikalische Beschränkung durch die 3D-Anordnung der Lipide im kleineren Winkel der Membranfalte.
Die molekularen Werkzeuge, die für die Biegung einer Membran benötigt werden, werden in bestimmten Regionen der Membran rekrutiert. Diese Mikrodomänen können eine spezifische Lipidzusammensetzung oder eine besondere elektrische Ladungsumgebung aufweisen. Phosphoinositide (PIPs), vor allem PIP2 und PIP3, sind Lipide, die zur Rekrutierung von Proteinen für die Biegung der Membran beitragen. Sie sind nützliche Moleküle, weil die elektrische Ladung und die molekulare Struktur ihrer polaren Köpfe durch chemische Reaktionen leicht verändert werden können. Auf diese Weise können sich die Eigenschaften einer bestimmten Membranregion bei Bedarf ändern und spezifische Proteine rekrutieren. Phosphatidylserin ist auch in der Lage, eine Mikrodomäne für die Biegung der Membran zu initiieren, wenn es durch Flipasasen von einer Monolage zur anderen verlagert wird.
Biegung und Verdickung
Lipid-Mikrodomänen rekrutieren Proteine, die die Membran effektiv biegen. Es gibt spezialisierte Proteine für diese Aufgabe (Abbildung 6). BAR-Domänenproteine (Bin/amphyphysin/Rsv161) sind eines von ihnen. Die Biegung kann durch zwei Mechanismen ausgelöst werden: durch den Aufbau eines gekrümmten Gerüsts aus Proteinen, die die Membran ziehen oder schieben, und durch das Einfügen von Aminosäuresequenzen zwischen die Lipide als Keil. So bewirken beispielsweise Caveoline die Krümmung der Membran zur Bildung von Caveloae, Tetraspain zwingt die Membranen zur Bildung von Tubuli und ESCRT hilft bei der Vesikelbildung in Endosomen zur Bildung von multivesikulären Körpern. Aktin ist durch die Polymerisation von Aktinfilamenten ein starker Membranbieger, der die Plasmamembran nach außen drückt, was zu Zellexpansionen führt. Viele Proteine, die die Plasmamembran biegen können, aktivieren auch die Aktinpolymerisation.
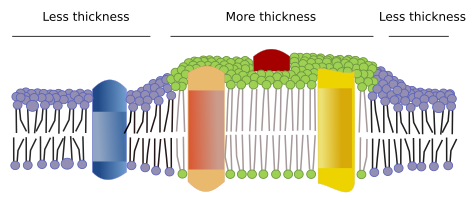
Es gibt weitere Bereiche in Membranen, physikalische Bereiche, die von Molekülen wie Transmembranproteinen gebildet werden. Diese Bereiche weisen eine andere Membrandicke auf, weil sie Proteine mit längeren hydrophoben Aminosäuresequenzen enthalten, die von Lipiden mit längeren Fettsäureketten umgeben werden (Abbildung 7). Diese Proteine und Lipide „fühlen“ sich wohler, wenn sie zusammen sind, da sie ihre hydrophoben Teile gut aufeinander abstimmen. Sie bilden Membrandomänen, die andere Moleküle, entweder Proteine oder Lipide, mit kürzeren hydrophoben Bereichen ausschließen.
Bibliografía
Honigmann A, Pralle A. (2016). Compartmentalization of the cell membrane. Journal of Mollecular Biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Membrankrümmung in der Zellbiologie: eine Integration der molekularen Mechanismen. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). High cholesterol/low cholesterol: effects in biologicalmembranes: a review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.