Proprietăți chimice ale oxidului de litiu, utilizări, producție
Proprietăți chimice
Oxidul de litiu (Li2O) este unul dintre cei mai simpli oxizi ionici și este izoelectronic cu H2O. Doi atomi de litiu vor da fiecare câte un electron atomului de oxigen. formează legătura ionică între litiu și oxigen. Formula pentru oxidul de litiu este Li2O.
Oxidul de litiu este foarte coroziv. Acesta reacționează cu apa pentru a produce hidroxid de litiu. Este toxic din cauza alcalinității sale puternice (fiind o bază).
Este o sursă de litiu foarte insolubilă și stabilă din punct de vedere termic, potrivită pentru aplicații în sticlă, optică și ceramică. Oxidul de litiu este un solid alb cunoscut și sub numele de litiu, este produs atunci când litiul metalic arde în prezența oxigenului. Compușii de oxid nu sunt conductori de electricitate. Cu toate acestea, anumiți oxizi structurați pe bază de perovskit sunt conductori electronici, găsindu-și aplicații în catodul celulelor de combustibil cu oxid solid și în sistemele de generare a oxigenului. Aceștia sunt compuși care conțin cel puțin un anion de oxigen și un cation metalic.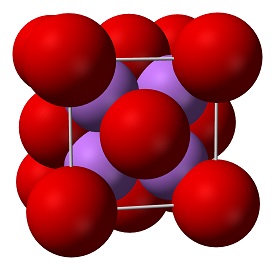
Oxidul de litiu este utilizat ca fondant în smalțurile ceramice; și creează albastru cu cupru și roz cu cobalt. Oxidul de litiu reacționează cu apa și aburul, formând hidroxid de litiu și trebuie izolat de acestea. Utilizarea sa este, de asemenea, investigată pentru evaluarea spectroscopiei de emisie nedistructivă și monitorizarea degradării în cadrul sistemelor de acoperire cu barieră termică. Poate fi adăugat ca și co-dopant cu ytriu în stratul de acoperire din ceramică de zirconiu, fără o scădere mare a duratei de viață preconizate a stratului de acoperire.
Utilizări
Nu există în prezent utilizări industriale care să consume cantități mari de oxid de litiu.
Oxidul de litiu este utilizat ca fondant în smalțurile ceramice; și creează albastru cu cupru și roz cu cobalt. Oxidul de litiu reacționează cu apa și aburul, formând hidroxid de litiu și ar trebui izolat de acestea. utilizarea sa este, de asemenea, investigată pentru evaluarea spectroscopiei de emisie nedistructivă și monitorizarea degradării în cadrul sistemelor de acoperire cu barieră termică. Poate fi adăugat ca și co-dopant cu ytriu în stratul de acoperire din ceramică de zirconiu, fără o scădere mare a duratei de viață preconizate a stratului de acoperire.
Reacții
Oxidul de litiu reacționează cu apa pe măsură ce se dizolvă pentru a forma o soluție de hidroxid de litiu.
Oxidul de litiu este o bază puternică și reacționează în mod obișnuit cu gazele și lichidele acide pentru a forma săruri de litiu. La temperaturi ridicate, oxidul de litiu reacționează, de asemenea, cu mulți oxizi nemetalici solizi (SiO2, B2O3 etc.) și oxizi metalici (A12O3, Fe2O3 etc.). Reacțiile la temperaturi ridicate stau la baza acțiunii de fluxare a oxidului de litiu, a hidroxidului de litiu și a carbonatului de litiu. Trebuie să se aibă grijă pentru a evita reacția oxidului de litiu cu vasele de reacție la temperaturi ridicate.
Preparare
Oxidul de litiu se prepară prin încălzirea litiului metalic în oxigen uscat la peste 100°C:
4Li + O2→2Li2O
O altă metodă de preparare care dă oxid de litiu pur implică descompunerea termică a peroxidului de litiu:
2Li2O2→2Li2O + O2
De asemenea, oxidul poate fi produs prin încălzirea hidroxidului de litiu pur la 800°C în vid:
2LiOH→Li2O + H2O
Pericol pentru sănătate
Din câte știm noi, proprietățile chimice, fizice și toxicologice ale oxidului de litiu nu au fost investigate și raportate în detaliu.
Toxicitatea compușilor de litiu este în funcție de solubilitatea lor în apă. Ionul de litiu are toxicitate asupra sistemului nervos central. Efectele inițiale ale expunerii la litiu sunt tremurături ale mâinilor, greață, micțiune, dificultăți de vorbire, lentoare, somnolență, vertij, sete și creșterea volumului de urină. Efectele unei expuneri continue sunt apatie, anorexie, oboseală, letargie, slăbiciune musculară și modificări ale ecg-ului. Expunerea pe termen lung duce la hipotiroidism, leucocitoză, edeme, creștere în greutate, polidipsie/poliurie (creșterea aportului de apă care duce la creșterea debitului urinar), tulburări de memorie, convulsii, leziuni renale, șoc, hipotensiune, aritmii cardiace, comă, moarte.
Proprietăți chimice
pulbere(e) albă(e) fin divizată(e) sau material crustos; absoarbe cu ușurință CO2 și H2O din atmosferă; se obține prin încălzirea LiOH la ~800°C în vid sau prin descompunerea termică a peroxidului de litiu; utilizat în ceramică și în formulări speciale de sticlă și în bateriile termice cu litiu
Utilizări
Oxidul de litiu este un alcalin puternic care absoarbe dioxidul de carbon și apa din atmosferă. Este utilizat la fabricarea ceramicii și a unor tipuri speciale de sticlă.
Utilizări
Ceramică și formulări speciale de sticlă, absorbant de dioxid de carbon
Preparare
Preparate industriale și de laborator. Numai cantități mici de material sunt preparate industrial. Atât preparatele industriale cât și cele de laborator necesită descompunerea termică a peroxidului de litiu sau a hidroxidului de litiu.
Peroxidul de litiu, Li202 , este transformat în oxid de litiu, Li20, și oxigen prin încălzire la 450° într-un curent de heliu gazos.
Deshidratarea termică a hidroxidului de litiu se realizează la 675°C±10° sub vid într-un recipient de nichel căptușit cu folie de argint.
Carbonatul de litiu poate fi transformat în oxid de litiu și dioxid de carbon prin încălzirea materialului la 700°C sub vid într-o barcă de platină.
Utilizări industriale. Nu există în prezent utilizări industriale care să consume cantități mari de oxid de litiu.
Oxidul de litiu reacționează cu apa pe măsură ce se dizolvă pentru a forma o soluție de hidroxid de litiu.Oxidul de litiu este o bază puternică și reacționează în mod obișnuit cu gazele și lichidele acide pentru a forma săruri de litiu. La temperaturi ridicate, oxidul de litiu reacționează, de asemenea, cu mulți nemetaloxizi solizi (Si02, B2O3 etc.) și oxizi metalici (A1203 , Fe2C>3 etc.). Reacțiile la temperaturi ridicate stau la baza acțiunii de fluxare a oxidului de litiu, a hidroxidului de litiu și a carbonatului de litiu. Trebuie să se aibă grijă pentru a evita reacția oxidului de litiu cu vasele de reacție la temperaturi ridicate.