Background
Artemisia annua este o plantă medicinală chineză (cunoscută și sub numele de „qing hao” sau „pelin dulce”) cu o activitate anti-malarie bine dovedită (1). Terapiile combinate pe bază de derivați de artemisinină (ACT) sunt recomandate de Organizația Mondială a Sănătății (OMS) pentru tratamentul malariei necomplicate în combinație cu agenți antimalarie eficace (2). Chimioprofilaxia pentru călători depinde de destinația de călătorie endemică pentru malarie și include o combinație deatovaquon/proguanil, clorochină, doxiciclină, meflochină sau primachină (3, 4). Au fost descrise cazuri de infecție malarică sub chimioprofilaxie cu derivați de artemisinină (5), iar OMS nu recomandă utilizarea materialului vegetal de A. annua, sub nicio formă, inclusiv ceaiul, pentru tratamentul sau prevenirea malariei (6).
Suplimentele pe bază de plante și dietetice (HDS) sunt din ce în ce mai utilizate în întreaga lume, iar leziunile hepatice induse de HDS devin o preocupare din ce în ce mai mare (7). În ciuda utilizării pe scară largă a ACT-urilor în zonele endemice de malarie, leziunile hepatice derivate din artemisinină sunt rare (8, 9). Kumar a raportat un caz al unui pacient care a dezvoltat o leziune hepatică colestatică la 6 săptămâni după ce a luat pe cale orală un supliment pe bază de plante care conținea artemisinină pentru menținerea sănătății generale (10). Există alte câteva publicații legate de leziuni hepatice induse de Artemisia annua- (9, 11-14). Un ghid clinic pentru evaluarea cauzalității și stabilirea diagnosticului de leziuni hepatice induse de plante medicinale a fost propus recent de către Asociația chineză de medicină chineză (15). Prezentăm un caz de hepatită acută colestatică datorată consumului de ceai de Artemisia ca chimioprofilaxie la un pacient care se întorcea din Etiopia.
Raport de caz
Un bărbat în vârstă de 51 de ani s-a prezentat la departamentul de urgență al Spitalului Universitar din Basel, Elveția, cu stare de rău, disconfort abdominal, scaune galbene plutitoare, icter și colurie cu o durată de 4 zile și o pierdere în greutate de 6-8 kg în ultimele 6 săptămâni. Se întorsese dintr-o călătorie de 4 săptămâni în Etiopia cu 3 săptămâni înainte de a solicita asistență medicală. În timpul șederii sale în Etiopia, a consumat zilnic 1,25 g de ceai pulbere de Artemisia annua ca chimioprofilaxie pentru malarie. În aproximativ 90% din cazuri a diluat pulberea în apă clocotită, iar în restul de 10% pulberea a fost ingerată amestecată cu alimente. Suplimentul fusese achiziționat prin intermediul internetului. Pacientul ne-a pus la dispoziție recipientul, care conținea inițial 50 g de o pulbere de culoare verde închis (figura 1). La prezentare, în recipient mai erau 2 g, ceea ce indică faptul că acesta consumase în total 48 g. În timpul șederii sale în Etiopia, acesta consumase și alte preparate asemănătoare ceaiului . Din cunoștințele noastre, nu a fost descrisă nicio hepatotoxicitate legată de aceste substanțe. El a negat că ar fi luat alte medicamente cu prescripție medicală, fără prescripție medicală sau pe bază de plante. Nu avea antecedente anterioare sau familiale de boli hepatice, abuz de alcool sau droguri sau factori de risc pentru hepatita virală. El a raportat că soția sa, care l-a însoțit în călătoria sa în Etiopia, a consumat, de asemenea, ceai de Artemesia annua pentru profilaxia malariei. Ea a rămas bine pe tot parcursul tratamentului.

Figura 1. Ceai de pulbere de Artemisia annua.
În afară de icterul marcat, era într-o stare generală bună și avea semne vitale neremarcabile (afebril cu tensiune arterială, ritm cardiac și frecvență respiratorie normale).
Testele de laborator au arătat: alanin aminotransferază (ALAT) 91 U/L (normal, 9-59); aspartat aminotransferază (ASAT) 42 U/L (normal, 9-34); fosfatază alcalină (ALP) 151 U/L (normal, 40-130); gama-glutamil transferază (GGT) 416 U/L (normal, 12-68); bilirubină totală 186.6 μmol/L (normal, 0-24) (bilirubina conjugată 168,5 μmol/L); și raportul internațional normalizat (INR) 0,9 (normal, 0,9-1,3). Nivelul de acizi biliari a fost ridicat la al nivel de 460,5 μmol/L (normal, 0-8,0). Numărătoarea diferențială a sângelui și proteina c-reactivă au fost normale. Erau prezente hiponatremia ușoară și hipocloremia, în concordanță cu aportul crescut de apă al pacientului în zilele precedente. Testele serologice pentru hepatita acută A, B, C și E, virusul Epstein-Barr și infecția cu citomegalovirus au fost negative. Coeruloplasmina a fost normală. Autoanticorpii specifici pentru ficat (anticorpii antinucleari, anticorpii antineutrofile, anticorpii antimusculare netede, anticorpii antimitocondriali, anticorpii anti-proteinază 3 și anticorpii antimieloperoxidază) au fost negativi, iar IgA, IgM și IgG au fost în limite normale. Ecografia abdominală a arătat un parenchim hepatic, vase și canale biliare normale. Elastografia hepatică a fost ridicată (FibroScan, 12,7 kPa, interval normal <5 kPa).
Pacientul a fost, de asemenea, evaluat la Institutul Tropical și de Sănătate Publică din Elveția pentru diverse potențiale afecțiuni infecțioase subiacente. Anticorpii împotriva rickettsiei febra pătată au fost pozitivi, totuși, acest lucru a fost considerat fără legătură cu prezentarea clinică și nu a fost inițiată nicio terapie cu antibiotice.
Biopsia hepatică inițială a arătat o hepatită portală cu infiltrare limfocitară a căilor biliare și bilirubinoză difuză intracanaliculară și intracitoplasmatică. Nu s-a observat nici fibroză, nici material parazitar (figurile 2A,B). O analiză de secvențiere de generație următoare pe ADN din leucocitele din sângele periferic pentru variante genetice în genele care codifică cei mai importanți 3 transportatori hepatici pentru homeostazia acizilor biliari, și anume BSEP, MDR3 și FIC1, nu a găsit nicio variantă tipic asociată cu boli hepatice colestatice ereditare.
FIGURA 2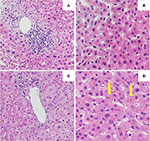
Figura 2. Histologia primei (A,B) și a celei de-a doua (C,D) biopsii hepatice. (A) Vedere cu putere redusă a biopsiei hepatice care arată un infiltrat limfocitar portal . (B) Parenchimul hepatic cu bilirubinostază intracelulară (HE, 20x). (C) Vedere cu putere redusă a biopsiei hepatice fără inflamație portală semnificativă (HE, 10x). (D) Parenchim hepatic cu bilirubinostază intracelulară și extracelulară semnificativă (săgeată) (HE, 20x).
Analiza toxicologică a ceaiului de Artemisia prin cromatografie lichidă-spectrometrie de masă și cromatografie în fază gazoasă – spectrometrie de masă a evidențiat următoarele ingrediente: arteannuin b, deoxyartemisină, camfor și scopoletină.
A fost inițiat un tratament cu prednison 20mg de două ori pe zi și acid ursodeoxicolic 500 mg de două ori pe zi. Din cauza icterului persistent, precum și a creșterii bilirubinei pe parcursul a 4 săptămâni în ciuda tratamentului, a fost efectuată o a doua biopsie hepatică. A doua biopsie a arătat o bilirubinostază intracitoplasmatică severă, precum și intracanaliculară, cu o inflamație minimă în comparație cu prima biopsie (figurile 2C,D). Tratamentul cu corticosteroizi a fost întrerupt, acidul ursodeoxicolic a fost continuat până la rezolvarea icterului și normalizarea bilirubinei (15,3 μmol/l) (Figura 3) și scăderea relevantă a acizilor biliari (19,5 μmol/l), care a avut loc la trei luni de la debutul bolii.
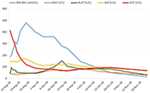
Figura 3. Evoluția în timp a bilirubinei și a enzimelor hepatice.
Cazul a fost raportat la unitatea de farmacovigilență a autorității naționale elvețiene pentru produse terapeutice (Swissmedic). A fost obținut consimțământul informat în scris de la participant pentru publicarea acestui raport de caz.
Discuție
Derivatele de artemisinină sunt o piatră de temelie pentru tratamentul, dar nu și pentru chimioprevenirea malariei (2). În ciuda utilizării lor pe scară largă, leziunile hepatice provocate de artemisinin-derivate au fost rareori descrise (8, 10). Din câte știm, acesta este primul raport de caz de hepatită acută colestatică datorată consumului de ceai de Artemisia annua.
Leziunea hepatică indusă de suplimentele pe bază de plante și dietetice este un subiect de interes crescând, deoarece HDS sunt utilizate din ce în ce mai mult în întreaga lume (7). Consumul de HDS este adesea considerat inofensiv, cu toate acestea, a fost raportat un număr tot mai mare de evenimente adverse care apar în paralel cu utilizarea acestora (16). În plus, deoarece concentrația și compoziția HDS nu sunt adesea declarate pe etichetele produselor, calitatea și cantitatea ingredientelor rămân necunoscute. În cazul nostru, diagnosticul de leziuni hepatice induse de HDS ca urmare a consumului de ceai de Artemisia annua s-a bazat pe relația temporală puternică dintre expunere și dezvoltarea reacției adverse și pe absența altor etiologii posibile. Am calculat scorul de evaluare a cauzalității în conformitate cu RUCAM (Roussel Uclaf Causality Assessment Method) (17) și am obținut un scor de 6 care corespunde unei cauzalități „probabile” a medicamentului incriminat. Diferitele elemente au fost punctate după cum urmează: timpul până la apariție (+2), evoluția (+1), factorii de risc (+1), medicamentele concomitente (-1), excluderea altor cauze de leziuni hepatice (+2), informații anterioare privind hepatotoxicitatea medicamentului (+1), răspunsul la readministrare (0). Nu au existat alte etiologii identificabile ale bolii hepatice.
Cazul descris anterior de Kumar a prezentat un model hepatocelular de leziuni hepatice, urmat de o fază colestatică prelungită (10). Pacientul nostru a prezentat un model predominant colestatic de leziuni hepatice la 5 săptămâni după prima ingestie de ceai de Artemisia annua. Presupunem că istoricul natural a fost similar cu cazul lui Kumar, dar că pacientul nostru s-a prezentat într-o etapă ulterioară în timpul evoluției leziunilor hepatice. În analiza toxicologică a ceaiului de plante ingerat am identificat în plus scopoletina și camforul, care se găsesc în mod natural în Artemisia annua (18, 19) și care ar fi putut contribui la declanșarea leziunii hepatice colestatice.
Mecanismul leziunii hepatice induse de derivații artemisininei rămâne neclar. Componentele chimice ale Artemisiae spp. includ uleiuri volatile, flavonoide, taninuri, triterpene și polizaharide. Uleiurile volatile din Artemisiae spp. au activități farmacologice puternice și toxicitate, iar o abordare bioinformatică recentă a identificat diverse căi care pot fi implicate în dezvoltarea leziunilor hepatice (20). Predispoziția la leziuni hepatice colestatice induse de medicamente a fost asociată cu polimorfismele pompei de export a sărurilor biliare (21, 22). Prin urmare, am căutat variante în transportatorii de acizi biliari prin secvențiere de generație următoare. Nu am detectat nicio deleție, duplicare sau variantă patologică în secvențele genice ABCB11, ATP8B1 și ABCB4 (regiunile codificatoare și flancate) care codifică pentru BSEP, FIC1 și, respectiv, MDR3 (figura 4). Cu toate acestea, au fost identificate o serie de variante de secvență comune. Pacientul nostru a găzduit în mod homozigot o variantă a genei ABCB11 . S-a dezbătut dacă acest polimorfism este asociat cu colestaza intrahepatică familiară benignă recurentă și/sau progresivă și colestaza intrahepatică de sarcină (23, 24). Mai mult, o altă variantă comună în gena ABCB11 a fost detectată în stare heterozigotă . Această variantă a fost asociată cu o expresie redusă a proteinei (25) și cu ciroza biliară primară (26, 27). Cu toate acestea, ambele variante genetice sunt mult prea frecvente în populația generală pentru a fi cauzale pentru bolile hepatice colestatice (28). Secvențierea sistematică a transcriptomului în astfel de cazuri poate identifica variante în alte regiuni ale secvențelor genetice sau în alte gene care codifică pentru alți transportatori hepatici sau proteine implicate în generarea bilei, cum ar fi ABCC2, ABCC3, ABCC4 și, respectiv, proteina 2 a joncțiunii strânse (TJP2) (21).
FIGURA 4
Figura 4. Analiza genetică moleculară a genelor ABCB11, ABCB4 și ATP8B1.
În concluzie, descriem un caz de leziune hepatică colestatică severă indusă de HDS, compatibilă cu consumul de ceai de Artemisia annua. Ar trebui depuse eforturi pentru a descuraja utilizarea derivaților de artemisinină pentru prevenirea malariei, care este ineficientă conform recomandărilor OMS și poate provoca în plus daune. Mai mult, acest caz demonstrează înțelegerea noastră încă inadecvată a fiziopatologiei și a susceptibilității la leziunile hepatice induse de HDS.
Declarație privind disponibilitatea datelor
Toate seturile de date pentru acest studiu sunt incluse în manuscris/fișiere suplimentare.
Declarație etică
Nu a fost necesară revizuirea și aprobarea etică pentru raportarea unui singur caz clinic aici, în conformitate cu legislația locală și cerințele instituționale. Pacientul/participantul și-a dat consimțământul în cunoștință de cauză în scris pentru participare.
Contribuții ale autorilor
FR-R a scris primul proiect al manuscrisului. SH, CB, AL-T, AL-T, MZ și AJ au scris secțiuni ale manuscrisului. FR-R, SH, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT și CB au contribuit la managementul clinic al pacientului, la revizuirea manuscrisului, au citit și aprobat versiunea trimisă.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
1. Klayman DL. Qinghaosu (artemisinina): un medicament antimalarie din China. Science. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | Full CrossRef Text | Google Scholar
2. Organizația Mondială a Sănătății. Liniile directoare ale OMS pentru tratamentul malariei, ed. a 2-a. (2010). Disponibil online la adresa: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (accesat la 23 noiembrie 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Disponibil online la adresa: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (accesat la 23 noiembrie 2018).
Google Scholar
4. Centrele pentru controlul și prevenirea bolilor. Alegerea unui medicament pentru prevenirea malariei (2018). Disponibil online la adresa: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Utilizarea abuzivă a artesunatului și malaria Plasmodium falciparum la călătorii care se întorc din Africa. Emerg Infect Dis. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | Refef Full Text | Google Scholar
6. Organizația Mondială a Sănătății. OMS, declarație de poziție. Eficacitatea formelor non-farmaceutice de Artemisia annua L. împotriva malariei. Geneva: Organizația Mondială a Sănătății (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Leziuni hepatice cauzate de suplimentele pe bază de plante și dietetice. Hepatologie. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Două cazuri de hepatită fulminantă în timpul unui tratament curativ cu o combinație artesunat-amodiachină. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract |Ref Full Text | Google Scholar
9. Centrele pentru controlul și prevenirea bolilor (CDC). Hepatită asociată temporar cu un supliment pe bază de plante care conține artemisinină – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Cholestatic liver injury secondary to artemisinin. Hepatologie. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | Full CrossRef Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. Un studiu clinic pilot randomizat, controlat cu placebo pentru a investiga eficacitatea și siguranța unui extract de Artemisia annua administrat pe parcursul a 12 săptămâni, pentru gestionarea durerii, a rigidității și a limitării funcționale asociate cu osteoartrita șoldului și genunchiului. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | Reflectarea textului integral | Google Scholar
12. Medsafe. Arthrem – Risc potențial de afectare a ficatului -Declarație în temeiul secțiunii 98 din Legea privind medicamentele din 1981 (2018). Disponibil online la adresa: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, Clinical and Research Information on Drug-Induced Liver Injury (Informații clinice și de cercetare privind leziunile hepatice induse de medicamente). Derivați ai artemisininei. (2019). Disponibil online la adresa: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicitate cu un supliment alimentar natural, Artemisia annua L. Extract în ulei de semințe de struguri. Rapoartele Centrului de Farmacovigilență din Noua Zeelandă. Siguranța medicamentelor (2018). În: 18th ISoP Annual Meeting „Pharmacovigilance without borders”. Geneva (accesat între 11 și 14 noiembrie 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Guidelines for the Diagnosis and Management of Herb-Induced Liver Injury. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | Reflectarea textului complet | Google Scholar
16. Clarke TC, Black LI, Black LI, Stussman BJ, Barnes PM, Nahin RL. Tendințe în utilizarea abordărilor complementare de sănătate în rândul adulților: Statele Unite, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM în leziunile hepatice induse de medicamente și plante medicinale: actualizare. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Differences in chemical constituents of Artemisia annua L from different geographical regions in China. PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variations in antimalarial components of Artemisia annua Linn from three regions of Uganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Analiza bazată pe rețele moleculare a mecanismului leziunilor hepatice induse de uleiurile volatile din Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | Reflect Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. Interferența cu funcția pompei de export a sărurilor biliare este un factor de susceptibilitate pentru leziunile hepatice umane în dezvoltarea medicamentelor. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Actualizare privind colestaza intrahepatică familială progresivă. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e318159606060
PubMed Abstract | Refref Full Text | Google Scholar
24.
. Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy (Genetica moleculară a colestazei intrahepatice a sarcinii). Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | Text integral | Google Scholar
25. Stieger B. The role of the sodium-taurocholate cotransporting polypeptide (NTCP) and of the bile salt export pump (BSEP) in physiology and pathophysiology of bila formation. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. Structura haplotipurilor BSEP și MDR3 la caucazieni sănătoși, ciroză biliară primară și colangită sclerozantă primară. Hepatologie. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | Ref. full text | Google Scholar
27. Pan S, Li X, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Variațiile genelor ABCB4 și ABCB11 sunt asociate cu calculi intrahepatici primari. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. Secvențierea FIC1, BSEP și MDR3 într-o cohortă mare de pacienți cu colestază a evidențiat un număr mare de variante genetice diferite. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar