1. Permeabilitate
2. Fluiditate
3. Heterogenitate
– Interioară
– Exterioară
– Încovoiere, grosime
Funcțiile membranelor celulare sunt determinate de compoziția lor moleculară. Tipul și proporția acestor molecule vor stabili caracteristicile fizico-chimice ale membranei: semipermeabilitatea, asimetria, fluiditatea, repararea și reciclarea.
Permeabilitatea
Semipermeabilitatea membranelor este o consecință a mediului hidrofob intern al membranelor, creat de lanțurile lipidice de acizi grași, care este greu de traversat de moleculele cu sarcini electrice. Astfel, prin împiedicarea difuziei libere a moleculelor, membranele pot forma compartimente care păstrează medii interne și externe distincte. Cu toate acestea, permeabilitatea este selectivă. Polaritatea și dimensiunea sunt cele mai importante caracteristici moleculare care influențează capacitatea de a traversa membranele. Moleculele mici fără sarcini electrice, cum ar fi CO2, N2, O2 și moleculele cu solubilitate mare în grăsimi, cum ar fi etanolul, pot traversa membranele aproape liber prin difuzie pasivă (figura 1). Permeabilitatea este mai mică pentru moleculele care au sarcini electrice atunci când numărul de sarcini pozitive este egal cu cel al sarcinilor negative, cunoscute ca molecule fără sarcină, cum ar fi apa și glicerolul. S-ar putea crede că apa poate traversa membranele în mod liber, dar există anumite restricții, motiv pentru care unele membrane conțin aquaporine, un tip de proteină transmembranară cu un canal care permite apei să traverseze liber. Capacitatea moleculelor mari neîncărcate, cum ar fi glucoza, de a traversa membranele este redusă. Membranele sunt foarte impermeabile la ioni și la moleculele încărcate. Câteva valori pentru coeficientul de permeabilitate prin difuzie pasivă sunt: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glicerol: 10 -6 cm/s, sodiu și potasiu: 10 -14 cm/s.
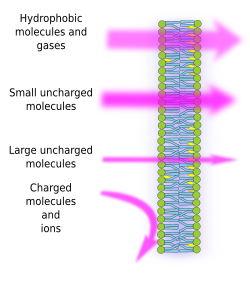
Distribuția inegală a ionilor și moleculelor între cele două părți ale unei membrane face posibilă generarea și menținerea gradienților electrochimici. Diferența dintre concentrația internă și cea externă a sarcinilor electrice este cunoscută sub numele de potențial de membrană. Acest gradient este utilizat pentru multe funcții celulare, cum ar fi sinteza ATP și transmiterea de informații de-a lungul nervilor. Semipermeabilitatea este, de asemenea, responsabilă pentru procesele osmotice, care sunt mișcări de apă de-a lungul membranelor de la o soluție mai puțin concentrată într-o parte la o soluție mai concentrată în cealaltă parte, pentru a egaliza ambele concentrații. În acest fel, celulele vegetale sunt capabile să crească în dimensiune datorită unei concentrații intracelulare mai mari a unor soluturi care fac ca apa să pătrundă în celulă, ceea ce, la rândul său, produce o presiune hidrostatică internă (numită presiune de turgescență) care împinge pereții celulari spre exterior. Moleculele care nu traversează liber membranele sunt utile pentru celule, deoarece pot crea gradienți care pot funcționa ca mecanisme de informare sau ca depozite de energie. Celulele au proteine transmembranare care permit traversarea membranei sau deplasarea moleculelor încărcate și a ionilor între ambele părți ale membranelor celulare, evitând mediul hidrofob al membranei interioare. De exemplu, contracția musculară este declanșată de deschiderea unor canale care reduc un gradient ionic existent.
Semipermeabilitatea este influențată de compoziția lipidică a membranelor. De exemplu, conținutul de colesterol este important în membrana plasmatică. O creștere a conținutului de colesterol scade fluiditatea și crește hidrofobicitatea, ambele caracteristici făcând membrana mai impermeabilă. Astfel, creșterea colesterolului cu peste 30 % (care este o valoare ridicată) face ca membranele de mielină să fie foarte potrivite pentru izolarea axonilor și pentru optimizarea propagării potențialului de acțiune de-a lungul axonului.
Fluiditatea și domeniile laterale
Fluiditatea este o proprietate a membranelor. Ea este legată de capacitatea moleculelor de a se mișca în interiorul membranelor. O fluiditate mai mare înseamnă că mișcările sunt mai frecvente. Membranele celulare sunt de fapt o foaie de grăsime, în care moleculele se află într-o stare vâscoasă semilichidă. Astfel, se poate ghici că moleculele se pot mișca prin difuzie. De exemplu, un glicerofosfolipid situat în monostrat extern al membranei plasmatice poate avea două tipuri de mișcări: lateral, adică în același monostrat, și flip-flop, adică sărituri de la un monostrat la altul (figura 2). În cazul membranelor artificiale, au fost observate aceste două tipuri de mișcări, mișcările laterale fiind mult mai frecvente decât cele de tip flip-flop. Prin difuzie laterală, lipidele pot parcurge 30 µm în 20 de secunde; ele pot parcurge întreaga circumferință a unei celule de dimensiuni medii într-un minut. Cu toate acestea, mișcările flip-flop sunt cu adevărat rare, deoarece capul hidrofil al moleculei lipidice trebuie să traverseze stratul intern al lanțurilor de acizi grași, iar acest lucru este dificil din punct de vedere termodinamic. Pentru o moleculă lipidică, probabilitatea unei deplasări de tip flip-flop este de aproximativ o dată pe lună. Cu toate acestea, colesterolul se comportă diferit și poate face flip-flop destul de ușor.

Fluiditatea membranei se poate schimba în funcție de compoziția chimică. În general, lanțurile de acizi grași mai scurte și o cantitate mai mare de legături nesaturate între carbonații acizilor grași cresc fluiditatea membranară. Cantitatea de colesterol influențează, de asemenea, fluiditatea membranară, dar efectul net depinde de temperatură și de tipul de lipide din membrană. Colesterolul are două efecte: inhibă trecerea la o stare de gel solid (mai puțină fluiditate), dar scade și flexibilitatea lanțurilor nesaturate de acizi grași. În general, se poate spune că o creștere a concentrației de colesterol scade fluiditatea membranei, deși la temperaturi scăzute efectul este invers. Membranele interne ale celulei, precum cele ale reticulului endoplasmatic, conțin foarte puțin colesterol și, prin urmare, sunt mai fluide. În plus, colesterolul conferă membranelor o altă proprietate cunoscută sub numele de hidofobicitate, care face ca membranele să fie mai impermeabile.
Compoziția moleculară diferită între cele două monostraturi ale unei membrane, cunoscută sub numele de asimetrie a membranei, poate genera o fluiditate distinctă în fiecare monostrat. În funcție de compoziția moleculară, lipidele se pot afla în două faze fizice: lichid-ordonat (mai puțină fluiditate) și lichid-dezordonat (mai multă fluiditate). Se presupune că monostraturile exterioare ale membranei plasmatice se află mai frecvent în faza lichid-ordonat, în timp ce monostraturile interioare sunt predispuse să se afle în faza lichid-dezordonat.
Celulele pot modifica fluiditatea membranelor prin schimbarea compoziției chimice a acestora. De exemplu, bacteriile ajustează saturația și lungimea lanțurilor de acizi grași, astfel încât fluiditatea membranei poate fi adaptată la condițiile de mediu. Variația concentrației de glicerofosfolipide, cum ar fi fosfatidiletanolamina, poate, de asemenea, să moduleze fluiditatea. Unele insecte nu pot sintetiza steroli, cum ar fi colesterolul, iar sterolii din membranele lor provin din alimente. Acestea modifică fluiditatea membranelor lor celulare prin diferite concentrații de fosfatidiletanolamină.
Membrana internă a mitocondriilor trebuie să fie o barieră impermeabilă puternică pentru a crea și menține un gradient de protoni. Acest lucru ar putea fi realizat printr-o creștere a conținutului de colesterol. În acest fel, hidrofobicitatea este mai mare, dar în schimb colesterolul scade fluiditatea, care pare să fie foarte importantă pentru funcția proteinelor din această membrană. Mitocondriile rezolvă problema cu ajutorul cardiolipinei, un fosfolipid nesaturat care crește hidrofobicitatea, dar nu reduce prea mult fluiditatea membranei.
3. Heterogenitatea
Din cauza fluidității, se poate crede că proteinele sunt distribuite la întâmplare și, prin urmare, membranele sunt omogene în ceea ce privește compoziția moleculară, adică prezintă același conținut molecular și aceeași proporție indiferent de regiunea membranară. Acest lucru nu este adevărat. Există restricții la difuzia laterală a moleculelor care determină eterogenitatea membranară, ceea ce înseamnă că există regiuni ale unei membrane cu o compoziție moleculară diferită. În celulele nepolarizate și la scări mai mari de 200 nm, membrana plasmatică pare omogenă, dar la scări mai mici de 200 nm este eterogenă. Se consideră că microdomeniile membranelor au o dimensiune de aproximativ 60 µm. Lipidele și proteinele prezintă mișcări laterale, în mare parte restrânse la zone de 60-200 nm, timp de câteva milisecunde, iar apoi sar într-o altă zonă adiacentă, unde rămân pentru încă un timp scurt. Acest comportament se numește difuzie saltatorie.
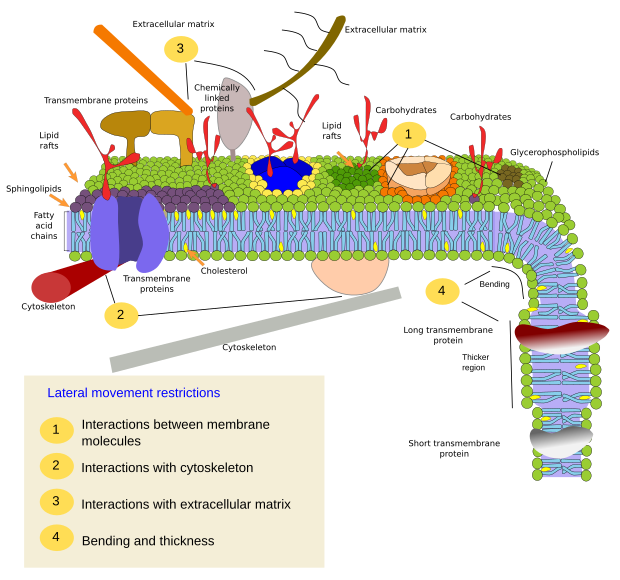
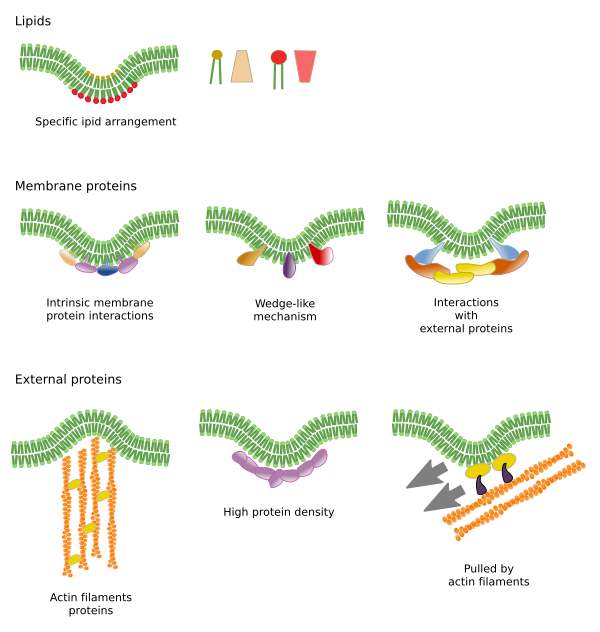
Restricțiile mișcărilor laterale ale moleculelor pot fi cauzate de mai multe mecanisme: interacțiuni cu citoscheletul sau cu matricea extracelulară, interacțiuni ale moleculelor membranare între ele, densități diferite ale zonelor locale ale membranei (modificări ale fluidității), cantitatea de sarcini electrice, curbura membranei și grosimea diferită a domeniilor membranare (Figura 3).
Interacțiuni interne
Interacțiunile moleculelor membranare între ele constrâng mișcările laterale. Atât mișcările proteinelor, cât și cele ale lipidelor sunt influențate de aceste interacțiuni care duc la formarea de microdomeni cu compoziție moleculară diferențiată (figura 4). Rezultatul este distribuția eterogenă laterală a moleculelor în membrane. În funcție de proporțiile moleculare, microdomeniile lipidice pot avea densități diferite (adică fluiditate): solide, lichide ordonate și lichide dezordonate. Cea mai frecventă densitate este cea a lichidului dezordonat, care este cel mai fluid.
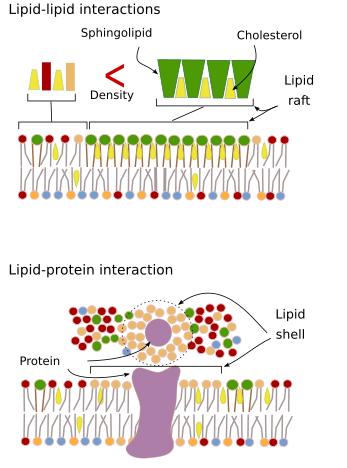
Sphingolipidele și colesterolul se pot asocia spontan între ele, reducându-și motilitatea și crescând densitatea moleculară în comparație cu zonele vecine. Un mic grup distinct de molecule se formează ca o plută într-o mare de lipide. De fapt, aceste asociații moleculare sunt cunoscute sub numele de rafturi lipidice și se crede că sunt foarte abundente și în membranele celulare. Rafturile lipidice prezintă un comportament extrem de dinamic, ele pot să se deplaseze, să crească, să se diminueze, să apară și să dispară. Într-adevăr, membranele sunt alcătuite din multe domenii dense care se deplasează lateral printre glicerofosfolipide, astfel încât membranele sunt destul de eterogene în ceea ce privește distribuția lor moleculară. Unele experimente sugerează că anumite tipuri de proteine se „simt” mai confortabil în interiorul plutoanelor lipidice. Aceste proteine petrec mai mult timp în interiorul rafturilor lipidice decât în afara lor, astfel că ele călătoresc o perioadă de timp în interiorul acestor densități. Acest lucru determină o segregare a moleculelor de-a lungul membranei și crește probabilitatea ca diferite molecule să se afle aproape una de cealaltă mai mult timp decât din întâmplare (difuzie), crescând astfel probabilitatea anumitor reacții moleculare. În plus, se sugerează că o concentrație ridicată a anumitor tipuri de lipide în plasele lipidice creează un mediu chimic distinct care facilitează anumite reacții chimice sau interacțiuni moleculare. S-a propus ca rafturile lipidice să fie prezente în monostraturile exterioare ale membranei plasmatice, deoarece în această parte sunt abundente sfingolipidele. S-a sugerat că domeniile membranare există și în membranele organitelor și se crede că unele dintre funcțiile acestora depind de aceste domenii membranare.
În monostraturile interioare ale membranei plasmatice, microdomeniile sunt formate prin interacțiuni electrostatice între domeniile citosolice de bază sau domeniile de cationi divalenți ale proteinelor și capetele polare negative ale lipidelor. Un alt exemplu mai puțin cunoscut este asocierea dintre fosfatidilinositol bifosfat și colesterol, care formează microdomeni în acest monostrat. Aceste microdomeni orientate spre citosol pot influența schelele proteice intracelulare.
În mod tradițional, s-a considerat că nu există interacțiuni între cele două monostraturi de membrane și că acestea își distribuie microdomeniile în mod independent. Cu toate acestea, dovezile sugerează că există interacțiuni între ele. Proteinele transmembranare afectează simultan ambele monolacri, deoarece traversează întreaga membrană. O altă modalitate de sincronizare între cele două monostraturi poate fi mediată de lanțurile lungi de acizi grași, cum ar fi unele sfingolipide care pot avea o lungime de 24 de carboni (lungimea normală este de 18). Aceste lanțuri lungi pot fi inserate printre lanțurile de acizi grași ale lipidelor din celălalt monostrat și pot influența distribuția lipidică. Mai mult, se crede că domeniile lipidice cu lanțuri lungi de acizi grași sunt contrabalansate de microdomeniile lipidice cu lanțuri scurte de acizi grași din celălalt monostrat, menținând constantă grosimea membranei.
Proteinele membranare, atât integrale cât și asociate, pot, de asemenea, să interacționeze între ele și să se asambleze în schelete macromoleculare pentru a facilita transmiterea de informații, recunoașterea celulă-celulă, demararea unor activități enzimatice și mișcarea celulară. Există, de asemenea, proteine multimerice active doar atunci când toate subunitățile sunt ținute împreună. De exemplu, receptorul de insulină este alcătuit din patru subunități. Proteinele și lipidele pot interacționa, de asemenea, pentru a forma domenii membranare. De exemplu, în monostraturile interne, fosfatidilinositolul se asociază în jurul proteinelor prin interacțiuni electrice, care pot fi reglementate prin modificarea fosfaților din capul polar al lipidelor.
Interacțiuni cu elementele exterioare
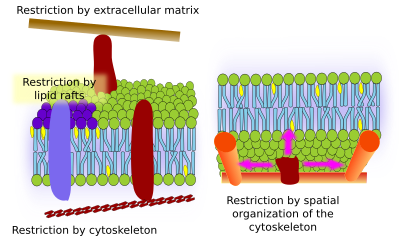
Proteinele membranare integrale pot avea, de asemenea, mișcări laterale, dar acestea sunt mai restrânse decât lipidele, în principal datorită interacțiunilor cu matricea extracelulară și cu citoscheletul prin intermediul domeniilor lor extracelulare și, respectiv, intracelulare (figura 5). Aceste interacțiuni pot menține proteinele în zone mici ale membranei timp mai îndelungat decât doar prin difuzie. Citoscheletul poate forma garduri chiar sub membrana plasmatică care mențin proteinele restricționate în zone mici. Filamentele de actină și microtubulii pot delimita zone mici care să limiteze difuzia proteinelor și a lipidelor. Interacțiunile cu citoscheletul sunt importante deoarece, în cazul în care citoscheletul este dezorganizat în mod experimental, membrana devine mult mai omogenă. Celulele dispun de alte mecanisme pentru a confina proteinele în domenii specifice. De exemplu, celulele epiteliale intestinale au unii transportatori și enzime localizate în membrana plasmatică apicală, dar nu și în domeniul bazo-lateral, din cauza unei centuri de joncțiuni strânse, un fermoar molecular care împiedică difuzia între domeniile apical și bazo-lateral. O astfel de distribuție asimetrică este esențială pentru fiziologia celulei epiteliale.
Îndoirea membranelor este o altă modalitate de a crea microdomenii. O curbură a membranei poate fi punctul de plecare pentru a forma o veziculă, o extensie a citoplasmei pentru expansiunea celulară, o schimbare de formă sau creșterea unui organit sau pur și simplu pentru a începe o barieră pentru restricționarea mișcării laterale a moleculelor. Aceasta este o restricție fizică prin dispunerea 3D a lipidelor în unghiul mai mic al pliului membranei.
Uneltele moleculare necesare pentru îndoirea unei membrane sunt recrutate în regiuni specifice ale membranei. Aceste microdomenii pot avea o compoziție lipidică specifică sau un mediu de sarcină electrică particular. Fosfoinozitidele (PIP), în principal PIP2 și PIP3, sunt lipide care contribuie la recrutarea proteinelor pentru îndoirea membranei. Acestea sunt molecule utile deoarece sarcina electrică și structura moleculară a capetelor lor polare pot fi ușor modificate prin reacții chimice. În acest fel, proprietățile unei anumite regiuni a membranei se pot modifica la nevoie și pot recruta proteine specifice. Fosfatidilserina este, de asemenea, capabilă să inițieze un microdomeniu pentru îndoirea membranei atunci când este translocată de la un monostrat la altul de către flipase.
Îndoire și îngroșare
Microdomeniile lipidice recrutează proteine care îndoaie eficient membrana. Există proteine specializate în acest rol (figura 6). Proteinele cu domeniu BAR (Bin/amphyphysin/Rsv161) sunt una dintre ele. Îndoirea poate fi indusă prin două mecanisme: asamblarea unui eșafodaj curbat de proteine care trag sau împing membrana și prin inserarea unor secvențe de aminoacizi printre lipide sub formă de pană. De exemplu, caveolinele determină curbarea membranei pentru a forma caveloane, tetraspaina forțează membranele să formeze tubuli, ESCRT ajută la formarea veziculelor în interiorul endosomilor pentru a forma corpuri multivesiculare. Actina este un agent puternic de curbare a membranei prin polimerizarea filamentelor de actină care împinge membrana plasmatică spre exterior, ceea ce duce la expansiuni celulare. Multe proteine care pot curba membrana plasmatică activează, de asemenea, polimerizarea actinei.
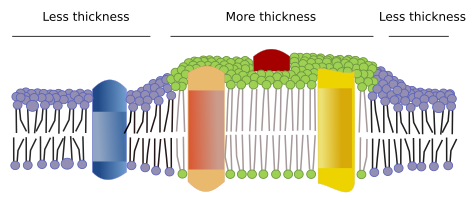
Există și alte domenii în membrane, domenii fizice, formate de molecule precum proteinele transmembranare. Aceste domenii prezintă o grosime diferită a membranei, deoarece conțin proteine cu secvențe de aminoacizi hidrofobi mai lungi care ajung să fie înconjurate de lipide cu lanțuri de acizi grași mai lungi (figura 7). Aceste proteine și lipide se „simt” mai confortabil atunci când sunt împreună, deoarece își potrivesc corect părțile hidrofobe. Ele formează domenii membranare care exclud alte molecule, fie proteine, fie lipide, cu regiuni hidrofobe mai scurte.
Bibliografie
Honigmann A, Pralle A. (2016). Compartimentarea membranei celulare. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Curbura membranei în biologia celulară: o integrare a mecanismelor moleculare. Jurnalul de biologie celulară. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Colesterol ridicat/colesterol scăzut: efecte în membranele biologice: o revizuire Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.