Podagra jest najczęstszą postacią artropatii zapalnej i szacuje się, że dotyka 1 na 40 osób w Wielkiej Brytanii.1
Wzrastającą częstość występowania podagry przypisuje się długowieczności, chorobom współistniejącym i czynnikom związanym ze stylem życia, takim jak otyłość.2
Arthritis Research UK i British Society for Rheumatology zwróciły uwagę na następujące problemy, które przyczyniają się do nieoptymalnego leczenia podagry w podstawowej opiece zdrowotnej, pomimo dostępności skutecznych metod leczenia:
- niepewność dotycząca rozpoczęcia terapii obniżającej poziom moczanów (ULT)
- nieobniżanie poziomu moczanów w stopniu wystarczającym do zapobiegania kolejnym atakom
- nieuwzględnianie czynników ryzyka pacjenta
- przestrzeganie zaleceń przez pacjenta.
W niniejszej aktualizacji przedstawiono najnowsze zalecenia dotyczące ostrego i długotrwałego leczenia podagry.
Cechy kliniczne i patogeneza
Podagra charakteryzuje się ostrym początkiem przeszywającego bólu stawów, z towarzyszącym obrzękiem, rumieniem i tkliwością. Pierwszy staw śródstopno-paliczkowy (MTP) jest najczęściej dotknięty pierwszym atakiem (ale podagra może dotyczyć innych stawów, takich jak kolanowy, skokowy i łokciowy).
W diagnostyce różnicowej należy zawsze brać pod uwagę zakażenie bakteryjne (septyczne zapalenie stawów). Inne przyczyny ostrego zapalenia jednego stawu obejmują inne krystaliczne artropatie, takie jak pseudogout, choroba zwyrodnieniowa stawów, uraz oraz reumatoidalne i seronegatywne zapalenie stawów.
Podagrę można rozpoznać na podstawie zebrania wywiadu i badania, ale w razie wątpliwości należy wykonać aspirację chorego stawu.
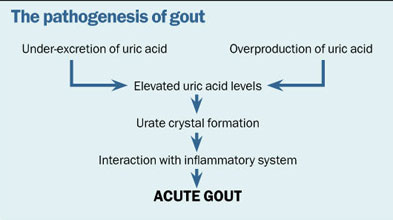
Podstawowym czynnikiem ryzyka podagry jest podwyższone stężenie kwasu moczowego w surowicy, ale nie u wszystkich pacjentów z hiperurykemią rozwinie się choroba. Dlatego też klinicysta powinien być ostrożny w sprawdzaniu poziomu kwasu moczowego u zdrowej osoby bez historii podagry. Poniższy schemat podsumowuje patogenezę podagry, którą należy docenić, aby zrozumieć cel postępowania terapeutycznego.
Leczenie ostrej podagry
W przypadku pacjenta bez przeciwwskazań, leczenie pierwszego rzutu obejmuje niesteroidowy lek przeciwzapalny (NLPZ), taki jak naproksen w dawce 750 mg początkowo, a następnie 250 mg co osiem godzin, aż do ustąpienia epizodu.
Diklofenak jest skuteczny, ale MHRA wydała ostrzeżenia dotyczące jego ryzyka sercowo-naczyniowego, które jest podobne do selektywnych inhibitorów Cox-2. Diklofenak jest obecnie przeciwwskazany u pacjentów ze stwierdzoną chorobą wieńcową, chorobą tętnic obwodowych, chorobą naczyniowo-mózgową i niewydolnością serca.3
Indometacyna, historycznie stosowana w leczeniu podagry, nie jest już zalecana ze względu na toksyczność żołądkowo-jelitową i nerkową.4
Przed przepisaniem NLPZ należy ocenić ryzyko wystąpienia działań niepożądanych ze strony przewodu pokarmowego u pacjenta i rozważyć dodanie IPP. Selektywny inhibitor cox-2 etorykoksyb w dawce 120 mg dziennie (przez maksymalnie osiem dni) jest kolejną alternatywą u pacjentów z ryzykiem toksyczności żołądkowo-jelitowej.4
Kolchicyna jest alternatywną terapią pierwszego rzutu w przypadku, gdy NLPZ są przeciwwskazane lub nie są tolerowane. Zaleca się stosowanie niskich dawek, 0,5 mg dwa do czterech razy dziennie. Jest to równie skuteczne jak tradycyjne większe dawki, ale powoduje mniejszą liczbę działań niepożądanych ze strony przewodu pokarmowego.
Przed przepisaniem kolchicyny u pacjentów przyjmujących wiele leków ważne jest sprawdzenie receptariusza pod kątem potencjalnych interakcji lekowych. Na przykład, istnieje zwiększone ryzyko toksyczności kolchicyny w przypadku stosowania antybiotyków makrolidowych oraz werapamilu i diltiazemu.5 BNF zaleca również ostrożność przy jednoczesnym przepisywaniu statyny ze względu na możliwe zwiększone ryzyko miopatii.
W przypadku gdy ani NLPZ, ani kolchicyna nie są tolerowane, można podać doustny lub dożylny glikokortykosteroid. Aspiracja stawu i wewnątrzstawowe wstrzyknięcie steroidu nie są powszechnie wykonywane, ale mogą przynieść natychmiastową ulgę.4
W odniesieniu do wytycznych dotyczących przepisywania doustnych steroidów, CKS (Clinical Knowledge Summaries) nie znalazło badań dotyczących optymalnej dawki lub czasu trwania leczenia prednizolonem w ostrej fazie podagry, ale stwierdza, że krótki kurs (np. 5 dni) 40 mg lub mniej jest stosunkowo bezpieczny.6
Ból i zapalenie mogą być również złagodzone przez miejscowe stosowanie okładów z lodu, przebywanie w chłodnym otoczeniu (na przykład unikanie siedzenia przed ogniem), utrzymywanie nawodnienia (2 litry płynów dziennie) i stosowanie klatki na łóżko (metalowa rama, która podnosi pościel), aby utrzymać pościel z dala od dotkniętej stopy.
Oprócz terapii, dobra komunikacja i wymiana informacji z pacjentem są niezbędne do skutecznego zarządzania. Najlepiej byłoby, gdyby pacjenci otrzymali ulotkę informacyjną na temat podagry lub odesłanie do zasobów internetowych (patrz piśmiennictwo).
Należy umówić się na wizytę kontrolną, ocenić i leczyć czynniki ryzyka występujące u pacjenta (patrz ramka 1) oraz przeprowadzić dokładny przegląd leków.
| Ramka 1: Czynniki ryzyka podagry | |
|---|---|
|
Czynniki stylu życia
|
Faktory medyczne
|
Wszyscy nowo zdiagnozowani pacjenci powinni mieć sprawdzoną masę ciała i ciśnienie tętnicze, a także stężenie glukozy we krwi, profil lipidowy i stężenie U&Es. Poziom moczanów w surowicy może spadać podczas ostrej fazy podagry, dlatego najlepiej jest sprawdzić poziom moczanów cztery do sześciu tygodni po ostrej prezentacji, aby ocenić poziom wyjściowy pacjenta i potwierdzić obecność hiperurykemii.
Poza wskazaniami dotyczącymi niewydolności serca lub przewlekłej choroby nerek (CKD), leki moczopędne powinny być odstawione, ponieważ mogą nasilać podagrę. Aspiryna ma związek z podagrą, ale uważa się, że małe dawki nie mają istotnego wpływu na stężenie moczanów w surowicy, dlatego należy ją kontynuować, jeśli jest stosowana w profilaktyce chorób układu krążenia. Należy jednak unikać stosowania przeciwbólowych dawek aspiryny.7
- Postrzeganie podagry jako czerwonej flagi dla powiązanych czynników ryzyka sercowo-naczyniowego
- Edukacja pacjenta i porady dotyczące stylu życia mają fundamentalne znaczenie dla skutecznego leczenia
- Rozpocząć leczenie allopurynolem, jeśli wystąpią trzy lub więcej ataków w ciągu roku
- Leczyć do docelowego poziomu moczanów w surowicy
- Nie przerywać leczenia allopurynolem, jeśli wystąpi ostry atak
Długotrwałe leczenie
Nadrzędnym celem długoterminowego leczenia podagry jest obniżenie stężenia moczanów w surowicy do wartości poniżej fizjologicznego progu wysycenia moczanów w tkankach organizmu.
Można to osiągnąć przez zapobieganie tworzeniu się nowych kryształów moczanu i/lub przez rozpuszczanie istniejących kryształów. Należy pamiętać, że niefarmakologiczne środki obniżające stężenie moczanów obejmują zmniejszenie masy ciała oraz ograniczenie spożycia alkoholu i puryn (patrz ramka 1).
Terapie obniżające stężenie moczanów
Terapie obniżające stężenie moczanów są podstawą długotrwałego postępowania farmakologicznego, a wskazania do ich rozpoczęcia to:
- Nawracające epizody podagry (na przykład trzy lub więcej w ciągu 12 miesięcy).
- Tworzenie tophi.
- Radiograficzne uszkodzenie stawów.
- Kamica moczanowa i nefropatia moczanowa.
Europejska Liga do Walki z Reumatyzmem określa docelowe stężenie moczanów w surowicy na <360mikromoli/l. Celem British Society for Rheumatology jest <300micromol/L. Arthritis Research UK zaleca „rozsądny kompromis pomiędzy tymi dwoma zaleceniami” i stwierdza, że „niższe poziomy są pożądane, kiedy tylko jest to możliwe”.
Najszerzej stosowanym środkiem ULT jest inhibitor oksydazy ksantynowej, allopurinol. Jest on wysoce skuteczny, łatwy do podawania i niedrogi. Jednak zbyt często przepisuje się dawki subterapeutyczne.8
Zwykła dawka początkowa allopurynolu wynosi 100 mg na dobę (50 mg w przypadku znacznej CKD). Dawki powinny być następnie zwiększane o kolejne 100 mg w zależności od poziomu moczanów w surowicy (sprawdzanie ich co cztery tygodnie byłoby rozsądnym odstępem czasu).8
Dawka podtrzymująca wynosi zwykle 300 mg na dobę, ale niektórzy pacjenci mogą wymagać większej dawki, przy czym maksymalna zalecana dawka wynosi 900 mg na dobę w dawkach podzielonych (u pacjentów z prawidłową czynnością nerek).4 Po osiągnięciu poziomów docelowych, pacjenci powinni mieć coroczne pomiary stężenia moczanów w surowicy, a leczenie jest zazwyczaj dożywotnie.
Najczęstszym działaniem niepożądanym allopurynolu jest wystąpienie ostrego zaostrzenia podagry. Jest to spowodowane obniżeniem stężenia moczanów, w wyniku czego kryształy moczanów są wyrzucane z chrząstki stawowej do przestrzeni stawowej, co prowadzi do ostrego stanu zapalnego. Wpływ i ryzyko wystąpienia zaostrzenia podagry wywołanego przez allopurynol można zmniejszyć przez:
- uprzedzenie pacjenta i zaoferowanie mu uspokojenia
- nieprzerywanie podawania allopurynolu w przypadku ostrego napadu
- unikanie rozpoczynania leczenia podczas ostrego napadu (należy odczekać około dwóch tygodni do ustąpienia ostrej podagry)
- rozpoczęcie leczenia w małych dawkach i stopniowe miareczkowanie
- przepisanie leku z grupy NLPZ (+/PPI) lub kolchicyny w małej dawce (0.5mg raz lub dwa razy dziennie) z allopurinolem, aż do osiągnięcia docelowego poziomu moczanów.3
Ważne! Nie należy przerywać stosowania allopurynolu w przypadku ostrego ataku choroby – należy uprzedzić pacjenta, unikać rozpoczynania leczenia w trakcie ataku choroby, rozpocząć leczenie od małych dawek i dodać NLPZ lub kolchicynę w małej dawce
Febuksostat
W podsumowaniu należy stwierdzić, że w podstawowej opiece zdrowotnej podagrę można dobrze leczyć za pomocą allopurynolu, jednak w przypadku pacjentów, którzy nie tolerują allopurynolu, odpowiednim lekiem może być nowy inhibitor oksydazy ksantynowej – febuksostat.
Badania wykazały lepsze osiąganie docelowego poziomu moczanów i jest on dobrze tolerowany.4 Brakuje jednak danych z badań dotyczących stosowania febuksostatu w porównaniu z allopurynolem miareczkowanym do pełnej dawki terapeutycznej.
NICE zatwierdziła febuksostat jako lek drugiego rzutu w długotrwałym leczeniu podagry, w przypadku gdy nie można zastosować allopurynolu, a jasne wskazówki dotyczące jego przepisywania można znaleźć na stronie cks.nice.org.uk/gout#!scenario:1.
W celu zapobiegania ostrym napadom podagry zaleca się jednoczesne przepisywanie febuksostatu z NLPZ lub kolchicyną.
- Dr Porter jest lekarzem pierwszego kontaktu w Essex
Zrób test z tego artykułu i odbierz swój certyfikat na stronie MIMS Learning
To jest zaktualizowana wersja artykułu, który został po raz pierwszy opublikowany w styczniu 2014 r.
Źródła
- Arthritis Research UK www.arthritisresearchuk.org
- UK Gout Society www.ukgoutsociety.org
- Kuo C-F, Grainge M, Mallen C, Zhang W et al. Ann Rheum Dis 2015; 74: 661-667
- Arthritis Research UK. Zaktualizowane wytyczne dotyczące podagry. Synovium spring 2013; issue 38.
- MHRA Diklofenak: nowe przeciwwskazania i ostrzeżenia. Czerwiec 2013.
- Arthritis Research UK. Gout: prezentacja i zarządzanie w podstawowej opiece zdrowotnej. Hands On summer 2011; issue 9.
- Terkeltaub RA, Furst D E, DiGiacinto J L, Kook, K A et al (2011), Arthritis & Rheumatism 2011: 63: 2226-2237
- Clinical Knowledge Summaries. Gout. Scenariusz: ostra postać podagry. Kwiecień 2015.
- Jordan KM, Cameron JS, Snaith M et al. British Society for Rheumatology and British Health Professionals in Rheumatology Guideline for the Management of Gout. Rheumatology 2007; 46 (8) 1372-1374
- Lipworth W, Kerridge I, Brett J et al. BMJ 2011; 343: d7459
.