Introduction
Według Światowej Organizacji Zdrowia, depresja dotyka szacunkowo 350 milionów ludzi na całym świecie (Organization, 2017). Pacjenci z depresją wskazują na objawy zaburzeń lękowych i towarzyszy im niezdolność do odczuwania przyjemności i zainteresowań, utrata koncentracji, zwątpienie w siebie, lęk społeczny, zaburzenia snu i apetytu (Namola i in., 2015). Głównymi czynnikami powodującymi depresję są chemikalia lub zaburzenia równowagi hormonalnej w mózgu. Głównym hormonem związanym z depresją jest serotonina. Inne hormony to noradrenalina i dopamina (Yi et al., 2008). Hormony te są niezbędne do normalnego funkcjonowania mózgu i do kontrolowania uczuć. Zniszczenie tych hormonów może spowodować brak równowagi chemicznej w mózgu, co prowadzi do depresji.
Depresja może być leczona w zależności od jej nasilenia, poprzez psychoterapię lub leki. Leki przeciwdepresyjne są głównymi rodzajami leków stosowanych w leczeniu depresji. Dostępnych jest wiele różnych rodzajów leków przeciwdepresyjnych, a różnią się one jedynie sposobem działania na mózg, kosztem i profilem działań niepożądanych. W pierwszej linii leczenia większość pacjentów otrzymuje albo trójcykliczny lek przeciwdepresyjny (TCA), albo selektywny inhibitor wychwytu zwrotnego serotoniny (SSRI; McCarthy i in., 2016). Lekami, które są powszechnie stosowane w leczeniu lęku, są benzodiazepiny. Mimo że na rynku istnieje wiele leków przeciwdepresyjnych stosowanych w leczeniu depresji, skutki uboczne stosowania tych leków budzą duże obawy (Binfaré i in., 2009). Alternatywną terapią depresji jest stosowanie leków ziołowych (Fajemiroye i in., 2016). Stosowanie ekstraktów ziołowych zyskuje coraz szerszą akceptację zarówno wśród przedstawicieli zawodów medycznych, jak i wśród pacjentów. Większość leków ziołowych wykorzystywanych w leczeniu depresji to surowe lub półpłynne ekstrakty (Calixto et al., 2000; Carlini, 2003; Guan i Liu, 2016).
Szkoda jest doniesień na temat badań obejmujących aktywną zasadę zdolną do wywoływania aktywności na ośrodkowy układ nerwowy (OUN). Przegląd dokonany przez Carliniego (2003) zawiera informacje jedynie o działaniu psychoanaleptycznym, psycholeptycznym i psychodysleptycznym. W ostatnim przeglądzie dokonanym przez Guan i Liu (2016) omówiono zależność struktura-aktywność działania przeciwdepresyjnego flawonoidów izolowanych ze źródeł naturalnych i syntetycznych. Syntetyczne alkaloidy indolowe, ich aktywność i potencjalne zastosowanie w medycynie były już przedmiotem przeglądu w kilku artykułach (de Sa i in., 2009). Nie ukazała się jednak praca przeglądowa korelująca wyizolowane roślinne alkaloidy indolowe z aktywnością przeciwdepresyjną. Niniejsza praca przeglądowa dostarcza informacji na temat potencjału naturalnych alkaloidów indolowych w leczeniu zaburzeń neurologicznych, badań zależności struktura-aktywność oraz stopnia ich powiązania z innymi bioaktywnymi metabolitami jako potencjalnych tropów leków przeciwdepresyjnych z punktu widzenia struktury chemicznej. It is compiled through bibliographic investigation of scientific journals and relevant literature identified through Web of Science electronic databases.
Antidepressant Plants
This review article deals with plants possessing activity on the CNS. Chociaż wiele rodzajów roślin należy do tej kategorii, podkreślimy tylko te, które wykazują właściwości przeciwdepresyjne. Na szczególną uwagę zasługują dwie rośliny zawierające alkaloidy indolowe: Passiflora incarnata L. (passiflora) i Mitragyna speciosa (Korth.) Havil (kratom), natomiast pozostałe dwie rośliny, u których nie stwierdzono obecności alkaloidów indolowych to Piper methysticum G. Forst (kava) i Valeriana officinalis L. Struktura chemiczna wyizolowanych związków z tych roślin może być wykorzystana jako podstawa do opracowania nowych leków.
Passiflora incarnata i inne gatunki, takie jak P. alata Curtis, P. coerulea L. i P. edulis Sims są szeroko stosowane jako środek uspokajający w medycynie tradycyjnej w większości krajów europejskich i w Ameryce (Houghton i Seth, 2003). Struktura leków z grupy benzodiazepin składa się z pierścienia benzenowego połączonego z układem diazepinowym zawierającym siedmioczłonową heterocykliczną cząsteczkę z dwoma atomami azotu w pozycjach 1 i 2 pierścienia. Alkaloidy indolowe wyizolowane z P. incarnata, mianowicie harman, harmol, harmina, harmalol i harmalina składają się z pierścienia benzenowego połączonego z pięcioczłonowym heterocyklem zawierającym jeden atom azotu.
Wiele badań wskazuje, że P. incarnata ma profil farmakologiczny podobny do benzodiazepin i działa poprzez receptory kwasu gamma-aminomasłowego (GABA) (Jawna-Zboińska i in., 2016). Liście M. speciosa były stosowane jako tradycyjna medycyna w leczeniu biegunki, cukrzycy i w celu poprawy krążenia krwi (Vicknasingam et al., 2010). Mitragynina jest głównym alkaloidem indolowym obecnym w M. speciosa wraz z jej analogami, speciogyniną, paynantheine i speciociliatine (León et al., 2009). Dwa badania przeprowadzone na wodnym ekstrakcie i alkaloidalnym ekstrakcie M. speciosa wywołały efekt przeciwdepresyjny w mysich modelach rozpaczy behawioralnej (Kumarnsit et al., 2007). Badanie przeprowadzone przez Idayu et al. (2011) na mitragyninie wykazuje działanie przeciwdepresyjne w zwierzęcym modelu behawioralnym depresji poprzez interakcję z osią podwzgórze-przysadka-nadnercza (HPA) w układzie neuroendokrynnym (Idayu et al., 2011).
Piper methysticum G. Forst jest spożywany w postaci napoju zwanego kava, który wywołuje przyjemny stan psychiczny w kierunku uczucia wesołości przy jednoczesnym zmniejszeniu zmęczenia i niepokoju (Bilia et al., 2002). Badanie wykazało, że większość działań farmakologicznych jest zachowana w ekstrakcie rozpuszczalnym w tłuszczach w porównaniu do ekstraktu wodnego. Rozpuszczalny w tłuszczach ekstrakt zawiera co najmniej siedem pironów, znanych jako kavalaktony. Kawalaktony generalnie oddziałują na neurotransmisje dopaminergiczne, serotoninowe, kwasu gamma aminomasłowego (GABA), glutamatergiczne, zapobiegają monoaminooksydazie B (MOB), a także zapewniają różnorodne efekty na kanały jonowe (Grunze et al., 2001). Dihydrometysticyna jest jednym z sześciu głównych kawalaktonów występujących w roślinie kava. Struktura dihydrometysticyny obejmuje aryloetylen-α-piron związany z indolopodobną cząsteczką zawierającą dwa oksygeny zamiast nitrogenów. Przyczynia się to do działania anksjolitycznego i działa jak leki przeciwdepresyjne. Podwójnie zaślepione badania kontrolowane placebo wykazały, że kawalaktony wykazują działanie anksjolityczne bez depresji funkcji umysłowych i motorycznych oraz poprawiają jakość snu. Kavalaktony są alternatywą do zastąpienia stosowania benzodiazepin w terapii depresji (Malsch i Kieser, 2001).
Valeriana officinalis L., znana również jako waleriana, jest szeroko stosowana w wielu krajach jako środek uspokajający, przeciwdrgawkowy, o działaniu hipnotycznym i anksjolitycznym (Ghaderi i Jafari, 2014). Kwas walerenowy i walepotriaty zostały zgłoszone jako składniki aktywne w preparatach farmaceutycznych, a komercyjne surowe ekstrakty waleriany odnotowały zastosowanie w wielu krajach (Bos et al., 2002). Walepotriaty, które obejmują triestry polihydroksycyklopenta-(c)-piranów z kwasami karboksylowymi: octowym, walerenowym, izowalerenowym, α-izowalerenowym, β-metylowalerenowym, β-acetoksyizowalerenowym, β-hydroksyizowalerenowym i β-acetoksy-β-metylowalerenowym, są stosowane jako środki uspokajające. Walepotriaty są niestabilne, termolabilne i szybko rozkładają się w środowisku kwaśnym lub zasadowym w wodzie, jak również w roztworach alkoholowych (Bos i in., 2002). Walepotriaty są przydatne w poprawie stanu zwierząt i ludzi podczas odstawiania benzodiazepin (Poyares i in., 2002).
Chociaż istnieje wiele różnych składników chemicznych, mechanizm działania jest opisywany jako interakcja waleriany z układem GABA w mózgu poprzez hamowanie transaminazy GABA, interakcję z receptorem GABA/benzodiazepiną oraz zakłócenie wychwytu i rekrutacji GABA w synaptosomach (Sichardt et al., 2007). Do badania przeciwdepresyjnego działania roślin wykorzystano różne modele. Modele farmakodynamiczne obejmują modele in vitro, in vivo oraz modele kliniczne, które zostały wykorzystane do oceny efektów (Tabela 1). Większość wybranych gatunków roślin poddano badaniom na poziomie in vivo, kilka badaniom in vitro, a jedynie kava została poddana badaniom klinicznym. We wszystkich przypadkach konieczne jest przeprowadzenie dalszych badań w celu ustalenia związków aktywnych, najbardziej skutecznej dawki oraz ustalenia, czy jest ona różna w różnych typach depresji.

TABELA 1. Informacje z badań farmakologicznych przeglądanych roślin.
Alkaloidy indolowe
Alkaloidy indolowe mają strukturę bicykliczną, składającą się z sześcioczłonowego pierścienia benzenowego połączonego z pięcioczłonowym pierścieniem pirolowym zawierającym azot. Ten pierścień pirolowy z atomem azotu daje początek podstawowym właściwościom alkaloidów indolowych, które czynią je szczególnie aktywnymi farmakologicznie (El-Sayed i Verpoorte, 2007). Alkaloidy indolowe są szeroko rozpowszechnione w roślinach należących do rodzin Apocynaceae, Loganiaceae, Rubiaceae i Nyssaceae. Ważne alkaloidy indolowe, które zostały wyizolowane z roślin, obejmują lek przeciwnadciśnieniowy, rezerpinę z Rauvolfia serpentina (Sagi i in., 2016) oraz silne leki przeciwnowotworowe, winblastynę i winkrystynę z Catharanthus roseus (El-Sayed i Verpoorte, 2007). Badania nad skutecznością alkaloidów indolowych w leczeniu depresji nie są nowe i prowadzone są od 1952 roku, jednak obecnie bardzo mało uwagi środowisko naukowe poświęca korzyściom płynącym z terapeutycznej przydatności roślin obdarzonych właściwościami przeciwdepresyjnymi.
Alkaloidy indolowe są często kojarzone z funkcją receptorów białek G, w szczególności dla neuronalnego przekazywania sygnałów poprzez receptory dla serotoniny (5-HT/hydroksytryptaminy). Oprócz donora wodoru w postaci wolnego N-H, obecność gęstości π-elektronów przyczynia się do zwiększenia energii najwyżej zajętego orbitalu molekularnego (HOMO) planarnego szkieletu indolowego. Umożliwia to oddziaływanie z nukleobazami, w szczególności z atomem protonowanym, jak również z białkami docelowymi (de Sa i in., 2009). Struktura chemiczna neuroprzekaźnika serotoniny oparta jest na bogatym w elektrony aromatycznym pierścieniu indolowym. Obecność atomu azotu w pierścieniu indolowym ma na celu utrzymanie układu aromatycznego i sprawia, że wiązanie N-H ma charakter kwaśny, a nie zasadowy. Pierścień indolowy jest zdolny do tworzenia wiązań wodorowych poprzez cząsteczkę N-H oraz oddziaływań π-π stacking lub kation-π, poprzez cząsteczkę aromatyczną (Shimazaki i in., 2009). Hydrofobowość pierścieni indolowych jest prawie taka sama jak podjednostki fenylowej, a mniej hydrofobowa niż klasycznych izosterycznych pierścieni benzotiofenowych i benzofuranowych. Grupa indolowa N-H odgrywa decydującą rolę w interakcji z docelowym bioreceptorem, podczas gdy zsyntetyzowane pochodne benzotiofenowe i benzofuranowe wykazują umiarkowane lub ograniczone powinowactwo do docelowego bioreceptora (de Sa i in., 2009). Rezerpina jest jednym z przykładów alkaloidów indolowych wyizolowanych w ciągu ostatnich 60 lat, które wykazują działanie uspokajające na OUN. Nawiasem mówiąc, dwa związki chemiczne, viz., tryptamina i serotonina znalezione w mózgu są również pochodne alkaloidów indolowych.
Obecnie aktywne składniki z ekstraktów roślinnych odpowiedzialne za efekt przeciwdepresyjny jest nadal niejasne. Dlatego staramy się zidentyfikować kilka ważnych struktur chemicznych wyizolowanych z ekstraktów roślinnych wykazujących aktywność przeciwdepresyjną i ustalić podobieństwo wzorów szkieletowych, które mogą przyczynić się do aktywności przeciwdepresyjnej. Wczesne próby zostały podjęte w celu identyfikacji strukturalnych podobieństw między serotoniną i alkaloidami indolowymi. Najbardziej wyraźne podobieństwo składa się z sześciu członów pierścieni heterocyklicznych fused do pięciu członów pierścieni. Różnica polega na obecności atomu azotu lub rozmieszczeniu elektronów π (rysunek 1). Poprzez badanie zależności struktura-aktywność Nichols (2012) stwierdził, że zróżnicowanie aktywności różnych typów cząsteczek sugeruje, że receptor jest bardzo wrażliwy na charakter tryptaminy. Inne związki chemiczne, które udało się wyizolować z roślin o działaniu przeciwdepresyjnym, zostały wymienione w niniejszym artykule przeglądowym, ponieważ są one być może specyficznymi agonistami z określonymi wzorcami substytucji, które są w stanie selektywnie aktywować podzbiór efektorów. Zjawisko to znane jest obecnie jako selektywność funkcjonalna.
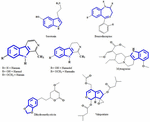
RYSUNEK 1. Struktury chemiczne związków serotoninowych, benzodiazepinowych i wyizolowanych związków z roślin o działaniu przeciwdepresyjnym. Podobieństwo we wzorze szkieletu, który składa się z sześcioczłonowych pierścieni heterocyklicznych, połączonych z pięcioczłonowymi pierścieniami.
Serotonina, jest szeroko stosowana w funkcji mózgu i poznania jako endogenny agonista receptora (Fink i Göthert, 2007). Serotonina wywiera swoje funkcje poprzez siedem rodzin receptorów (5-HT1-5-HT7), które są członkami rodziny receptorów sprzężonych z białkiem G. Szereg związków zawierających cząsteczkę indolową wykazuje powinowactwo do różnych receptorów serotoninowych (Kochanowska-Karamyan i Hamann, 2010). Podobieństwo strukturalne alkaloidów indolowych (egzogennych agonistów) do endogennych neuroprzekaźników, takich jak serotonina, skłoniło badaczy do przewidywania potencjalnej aktywności neurologicznej tych cząsteczek. Schemat procesów związanych z neurotransmisją egzogennych agonistów został opisany na rysunku 2.
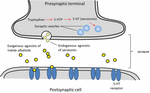
RYSUNEK 2. Schemat procesów związanych z neurotransmisją. Egzogenne agoniści alkaloidy indolowe z roślin dzielących podobieństwa struktury z serotoniny, która pozwala im wiązać się do receptorów serotoniny (receptory 5-HT).
Pierścień indolowy jest również znany jako bioizosteres i ma podobne chemiczne i fizyczne jak cząsteczki biologiczne. To podobieństwo jest wykorzystywane w rozwoju prototypu leku, który ma na celu poprawę aktywności farmakologicznej i optymalizacji profilu farmakokinetycznego. W innym badaniu oceny farmakologicznej benzofuranów i tienopiroli uzyskano cząsteczki bioizosteryczne, które posiadają aktywność podobną do dimetylotryptaminy. Wczesne prace z benzotiofenami i 3-indenalkiloaminami wykazały, że dla związków pozbawionych podstawników pierścieniowych, zdolność do działania jako agoniści w dnie oka szczura była mniej więcej taka sama jak tryptamin. Wyniki wykazały, że indolowa NH nie jest niezbędna do aktywacji receptora 5-HT2 w dnie oka szczura (Nichols, 2012). Seria 2-arylowych antagonistów indolowych receptora NK1 i ich pochodne są dobrymi ligandami, ale mają niską biodostępność doustną u szczurów. W celu zwiększenia rozpuszczalności i absorpcji wprowadzono azot zasadowy, co doprowadziło do powstania analogu azaindolu i związków pokrewnych wykazujących takie samo powinowactwo wiązania NK1 jak seria 2-arylowych antagonistów indolowych receptora NK1 (Cooper et al., 2001). Dokowanie molekularne 2 ligandów pochodnych fenyloindolu z receptorami serotoninowymi 5-HT6 i melanokortynowymi 4 wskazuje, że uprzywilejowane rusztowanie może być dostosowane w zależności od charakteru konserwowanej subkieszeni i niekonserwowanej kieszeni wiążącej. Interakcje niekonserwowanych części kieszeni wiążącej są odpowiedzialne za istotne różnice w rozpoznaniu molekularnym przez odpowiedni receptor docelowy (Bondensgaard i in., 2004).
Według de Sa i wsp. (2009) powszechne alkaloidy indolowe występujące w naturalnych źródłach to aminokwasy tryptofanu w żywieniu człowieka i odkrycie hormonów roślinnych, które mają działanie terapeutyczne, takie jak przeciwzapalne, inhibitor fosfodiesterazy, agoniści i antagoniści receptora 5-HT, agoniści receptora kannabinoidowego i inhibitory reduktazy HMG-CoA. Rusztowanie indolowe posiada kieszenie wiążące i wspólną komplementarną domenę wiążącą z docelowym receptorem, który należy do klasy GPCRs (G-protein important membrane receptors coupled). Większość leków dostępnych na rynku zawiera podstrukturę indolową. Należą do nich indometacyna, ergotamina, frowatryptan, ondansetron i tadalafil.
Wniosek
W niniejszym przeglądzie stwierdzono, że większość środków pochodzenia roślinnego wskazanych w leczeniu dolegliwości psychiatrycznych była surowa lub półprzetworzona. Wyniki dla in vivo i in vitro różnią się i nie były powtarzalne, ponieważ w różnych regionach biogeograficznych zawartość metabolitów wtórnych w roślinach koreluje z dostępnością składników odżywczych, klimatem i warunkami ekologicznymi. Ponadto do bioaktywności roślin może przyczyniać się pojedynczy związek lub mieszanina związków. Autorzy sugerują, że wysiłki zmierzające do uzyskania aktywnych składników, identyfikacji fitochemikaliów oraz badań metabolomicznych powinny być prowadzone z wykorzystaniem inspekcji in vitro i in vivo w celu lepszej charakterystyki leków roślinnych. W większości przypadków synteza alkaloidów indolowych była inspirowana naturalnie występującymi cząsteczkami i ich podobieństwem do serotoniny.
Alkaloidy indolowe ze źródeł roślinnych są dość złożone w porównaniu do syntetycznych. Znaczenie syntetycznych alkaloidów indolowych jest już ustalona, ponieważ struktura jest dostępna w różnych receptorów ligandów, inhibitorów enzymów i modulatorów bioreceptor. Niektóre z naturalnie występujących alkaloidów indolowych nie mogą być syntetyzowane za pomocą obecnie znanych metod. Ponadto, większość informacji na temat skuteczności alkaloidów indolowych została uzyskana z syntetycznych alkaloidów indolowych. W związku z tym potencjał wielu naturalnie występujących alkaloidów indolowych jako nowych leków na różne zaburzenia psychiczne pozostaje wciąż niewykorzystany. Historycznie, związki pochodzenia roślinnego były źródłem kilku z najbardziej udanych leków lub leków stosowanych w medycynie. To wskazuje, że więcej może leżeć w sklepie do odkrycia.
W podsumowaniu, kilka alkaloidów indolowych zostały zatrudnione jako leki przeciwdepresyjne lub zapewnić struktury ołowiu dla jego rozwoju. W oparciu o nasze wyniki, rośliny zawierają rezerwuar alkaloidów indolowych, które są cennymi punktami wyjścia do rozwoju przyszłych leków przeciwdepresyjnych.
Wkład Autora
HH: Przygotowanie manuskryptu. MY: Redagowanie języka angielskiego i sugerowanie niektórych ważnych informacji w celu poprawy manuskryptu. AR: Wkład w zrozumienie schematu procesów związanych z neurotransmisją.
Funding
Support for this work was provided by Universiti Malaysia Pahang via research grant UMP RDU170302 to HH.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Bilia, A. R., Gallori, S., and Vincieri, F. F. (2002). Kava-kava i lęk: rosnąca wiedza na temat skuteczności i bezpieczeństwa. Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., and Rodrigues, A. L. S. (2009). Podawanie kwasu askorbinowego wywołuje efekt przeciwdepresyjny: dowód na zaangażowanie neurotransmisji monoaminergicznej. Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., and Bywater, R. P. (2004). Recognition of privileged structures by G-protein coupled receptors. J. Med. Chem. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., and Pras, N. (2002). Determination of valepotriates. J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., and Yunes, R. A. (2000). Naturally occurring antinociceptive substances from plants. Phytother. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). Rośliny a ośrodkowy układ nerwowy. Pharmacol. Biochem. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl indole NK 1 receptor antagonists: optimisation of indole substitution. Bioorg. Med. Chem. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., and Alberto, C. (2009). From nature to drug discovery: the indole scaffold as a 'privileged structure’. Mini Rev. Med. Chem. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., and Verpoorte, R. (2007). Catharanthus terpenoid indole alkaloids: biosynthesis and regulation. Phytochem. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., and Costa, E. A. (2016). Leczenie lęku i depresji: rośliny lecznicze w retrospektywie. Fundam. Clin. Pharmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., and Weiss, G. (2011). Pharmacological studies in an herbal drug combination of St. John’s Wort (Hypericum perforatum) and passion flower (Passiflora incarnata): in vitro and in vivo evidence of synergy between Hypericum and Passiflora in antidepressant pharmacological models. Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., and Göthert, M. (2007). Regulacja receptorów 5-HT w uwalnianiu neuroprzekaźników. Pharmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., and Jafari, M. (2014). Efficient plant regeneration, genetic fidelity and high-level accumulation of two pharmaceutical compounds in regenerated plants of Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., and Walden, J. (2001). Pirony z Kavy wywierają na transmisję neuronalną i transmembranowe prądy kationowe wpływ podobny do znanych stabilizatorów nastroju – przegląd. Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., and Liu, B.-Y. (2016). Działanie przeciwdepresyjne i mechanizmy działania flawonoidów i pokrewnych analogów. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., and Winterhoff, H. (2008). Extracts of Valeriana officinalis L. sl show anxiolytic and antidepressant effects but neither sedative or myorelaxant properties. Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., and Seth, P. (2003). Rośliny a ośrodkowy układ nerwowy. Pharmacol. Biochem. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. (2011). Antydepressant-like effect of mitragynine isolated from Mitragyna speciosa Korth in mice model of depression. Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboińska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). Passiflora incarnata L. Improves spatial memory, reduces stress, and affects neurotransmission in rats. Phytother. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., and Hamann, M. T. (2010). Marine indole alkaloids: potential new drug leads for the control of depression and anxiety. Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., and Intasaro, P. (2007). Fos-like immunoreactivity in rat dorsal raphe nuclei induced by alkaloid extract of Mitragyna speciosa. Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., and Cutler, S. J. (2009). Phytochemical characterization of the leaves of Mitragyna speciosa grown in USA. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., and Kieser, M. (2001). Efficacy of kava-kava in the treatment of non-psychotic anxiety, following pretreatment with benzodiazepines. Psychopharmacology 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., and Dijk, D.-J. (2016). Homeostaza snu REM przy braku snu REM: Effects of antidepressants. Neuropharmacology 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., and Kothiyal, P. (2015). Depresja i rola biomateriałów morskich: przegląd. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). Structure-activity relationships of serotonin 5-HT 2A agonists. WIREs Membr. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organization, W. H. (2017). Depression Fact Sheet 2016. Dostępne na: http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., and Tufik, S. (2002). Can valerian improve the sleep of insomniacs after benzodiazepine withdrawal? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., and Khan, I. A. (2016). Quantification and characterization of alkaloids from roots of Rauwolfia serpentina using ultra-high performance liquid chromatography-photo diode array-mass spectrometry. Anal. Bioanal. Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., and Deed, G. (2009). The Kava Anxiety Depression Spectrum Study (KADSS): a randomized, placebo-controlled crossover trial using an aqueous extract of Piper methysticum. Psychopharmacology 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., and Yamauchi, O. (2009). Metal complexes involving indole rings: structures and effects of metal-indole interactions. Coord. Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., and Nieber, K. (2007). Modulation of postsynaptic potentials in rat cortical neurons by valerian extracts macerated with different alcohols: involvement of adenosine A1 and GABAA-receptors. Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). The informal use of ketum (Mitragyna speciosa) for opioid withdrawal in the northern states of peninsular Malaysia and implications for drug substitution therapy. Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., and Naidu, M. (2016). Mitragyna speciosa leaf extract exhibits antipsychotic-like effect with the potential to alleviate positive and negative symptoms of psychosis in mice. Front. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., and Kong, L.-D. (2008). Antydepresyjne-jak behawioralne i neurochemiczne skutki cytrusowych związanych chemicznych apigenin. Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar
.