Background
Artemisia annua jest chińskim ziołem leczniczym (znanym również jako „qing hao” lub „sweet wormwood”) o dobrze udowodnionej aktywności przeciwmalarycznej (1). Światowa Organizacja Zdrowia (WHO) zaleca stosowanie terapii łączonych opartych na pochodnych artemizyny (ACT) w leczeniu niepowikłanej malarii w połączeniu ze skutecznymi lekami przeciwmalarycznymi (2). Chemioprofilaktyka u podróżnych zależy od celu podróży obarczonego endemią malarii i obejmuje połączenie atowakwon/proguanil, chlorochinę, doksycyklinę, meflochinę lub prymachinę (3, 4). Opisano przypadki zakażenia malarią podczas stosowania chemioprofilaktyki opartej na pochodnych artemizyny (5), a WHO nie zaleca stosowania materiału roślinnego A. annua w jakiejkolwiek postaci, w tym herbaty, w leczeniu lub zapobieganiu malarii (6).
Suplementy ziołowe i dietetyczne (HDS) są coraz częściej stosowane na całym świecie, a uszkodzenie wątroby wywołane przez HDS staje się coraz większym problemem (7). Pomimo szerokiego stosowania ACT w obszarach endemicznych malarii, uszkodzenie wątroby wywołane przez pochodne artemizyny jest rzadkie (8, 9). Kumar opisał przypadek pacjenta, u którego doszło do cholestatycznego uszkodzenia wątroby 6 tygodni po doustnym przyjęciu suplementu ziołowego zawierającego artemizynę w celu utrzymania ogólnego stanu zdrowia (10). Istnieje kilka innych publikacji związanych z uszkodzeniem wątroby wywołanym przez Artemisia annua (9, 11-14). Wytyczne kliniczne dotyczące oceny przyczynowości i diagnozowania uszkodzeń wątroby wywołanych przez zioła zostały ostatnio zaproponowane przez Chińskie Stowarzyszenie Medycyny Chińskiej (15). Przedstawiamy przypadek ostrego cholestatycznego zapalenia wątroby spowodowanego spożyciem herbaty Artemisia w ramach chemioprofilaktyki u pacjenta powracającego z Etiopii.
Raport przypadku
51-letni mężczyzna zgłosił się na oddział ratunkowy Szpitala Uniwersyteckiego w Bazylei w Szwajcarii ze złym samopoczuciem, dyskomfortem w jamie brzusznej, żółtaczką i cholurią trwającymi 4 dni oraz utratą masy ciała o 6-8 kg w ciągu ostatnich 6 tygodni. 3 tygodnie przed zgłoszeniem się do lekarza wrócił z 4-tygodniowej podróży do Etiopii. Podczas pobytu w Etiopii codziennie spożywał 1,25 g sproszkowanej herbaty Artemisia annua jako chemioprofilaktykę malarii. W około 90% przypadków rozcieńczał proszek we wrzątku, w pozostałych 10% spożywał proszek zmieszany z jedzeniem. Suplement został zakupiony przez Internet. Pacjent przekazał nam pojemnik, który pierwotnie zawierał 50 g ciemnozielonego proszku (ryc. 1). W momencie prezentacji w pojemniku znajdowały się 2 g, co wskazuje, że pacjent spożył łącznie 48 g. Podczas pobytu w Etiopii pacjent spożywał również inne preparaty podobne do herbaty. Według naszej wiedzy nie opisano hepatotoksyczności związanej z tymi substancjami. Zaprzeczył przyjmowaniu jakichkolwiek innych leków na receptę, bez recepty lub ziołowych. Nie miał wcześniejszego ani rodzinnego wywiadu w kierunku chorób wątroby, nadużywania alkoholu lub narkotyków ani czynników ryzyka wirusowego zapalenia wątroby. Zgłosił, że jego żona, która towarzyszyła mu w podróży do Etiopii, również spożywała herbatę Artemesia annua w ramach profilaktyki malarii. Ona pozostała zdrowa przez cały czas.

Rysunek 1. Artemisia annua proszek herbaciany.
Oprócz wyraźnej żółtaczki, był w dobrym stanie ogólnym i miał nieistotne parametry życiowe (afebrile z prawidłowym ciśnieniem krwi, tętnem i częstością oddechów).
W badaniach laboratoryjnych stwierdzono: aminotransferazę alaninową (ALAT) 91 U/L (norma, 9-59); aminotransferazę asparaginianową (ASAT) 42 U/L (norma, 9-34); fosfatazę alkaliczną (ALP) 151 U/L (norma, 40-130); gamma-glutamylotransferazę (GGT) 416 U/L (norma, 12-68); bilirubinę całkowitą 186.6 μmol/L (norma, 0-24) (bilirubina sprzężona 168,5 μmol/L); oraz międzynarodowy współczynnik znormalizowany (INR) 0,9 (norma, 0,9-1,3). Poziom kwasów żółciowych był podwyższony do 460,5 μmol/L (norma, 0-8,0). Różnicowa morfologia krwi i białko c-reaktywne były prawidłowe. Łagodna hiponatremia i hipochloremia były obecne, co było zgodne ze zwiększonym spożyciem wody przez pacjenta w ciągu ostatnich dni. Testy serologiczne na ostre zapalenie wątroby typu A, B, C i E, zakażenie wirusem Epsteina-Barr i cytomegalowirusem były negatywne. Poziom koeruloplazminy był prawidłowy. Autoprzeciwciała specyficzne dla wątroby (przeciwciało przeciwjądrowe, przeciwciało przeciw neutrofilom, przeciwciało przeciw mięśniom gładkim, przeciwciało przeciwmitochondrialne, przeciwciało przeciw proteinazie 3 i przeciwciało przeciw mieloperoksydazie) były negatywne, a IgA, IgM i IgG były w normalnym zakresie. Ultrasonografia jamy brzusznej wykazała prawidłowy miąższ wątroby, naczynia i przewody żółciowe. Elastografia wątroby była podwyższona (FibroScan, 12,7 kPa, zakres normalny <5 kPa).
Pacjentka została również oceniona w Szwajcarskim Instytucie Zdrowia Tropikalnego i Publicznego pod kątem różnych potencjalnych chorób zakaźnych. Przeciwciała przeciwko riketsjom gorączki plamistej były dodatnie, jednak uznano to za niezwiązane z obrazem klinicznym i nie rozpoczęto antybiotykoterapii.
Wstępna biopsja wątroby wykazała wrotne zapalenie wątroby z limfocytarnym naciekiem dróg żółciowych i rozproszoną wewnątrzkanalikową i wewnątrzcytoplazmatyczną bilirubinostazą. Nie uwidoczniono włóknienia ani materiału pasożytniczego (ryc. 2A,B). Analiza sekwencjonowania następnej generacji DNA z leukocytów krwi obwodowej pod kątem wariantów genetycznych w genach kodujących 3 najważniejsze dla homeostazy kwasów żółciowych transportery wątrobowe, czyli BSEP, MDR3 i FIC1, nie wykazała wariantów typowo związanych z dziedzicznymi cholestatycznymi chorobami wątroby.
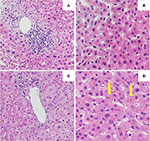
Rysunek 2. Histologia pierwszej (A,B) i drugiej (C,D) biopsji wątroby. (A) Low power view of hepatic biopsy showing a portal lymphocytic infiltrate . (B) Miąższ wątroby z wewnątrzkomórkową bilirubinostazą (HE, 20x). (C) Low power view of hepatic biopsy without significant portal inflammation (HE, 10x). (D) Parenchyma wątroby z istotną wewnątrzkomórkową i zewnątrzkomórkową (strzałka) bilirubinostazą (HE, 20x).
Analiza toksykologiczna herbaty Artemisia metodą chromatografii cieczowej – spektrometrii mas i chromatografii gazowej – spektrometrii mas ujawniła następujące składniki: arteannuinę b, deoksyartemizynę, kamforę i skopoletynę.
Początkowano leczenie prednizonem 20 mg 2 razy na dobę i kwasem ursodeoksycholowym 500 mg 2 razy na dobę. Ze względu na utrzymującą się żółtaczkę oraz narastanie bilirubiny w ciągu 4 tygodni pomimo leczenia wykonano drugą biopsję wątroby. Druga biopsja wykazała ciężką wewnątrzcytoplazmatyczną i wewnątrzkanalikową bilirubinostazę, z minimalnym tylko stanem zapalnym w porównaniu z pierwszą biopsją (ryc. 2C,D). Odstawiono kortykosteroidy, kontynuowano leczenie kwasem ursodezoksycholowym do czasu ustąpienia żółtaczki i normalizacji stężenia bilirubiny (15,3 μmol/l) (ryc. 3) oraz odpowiedniego obniżenia stężenia kwasów żółciowych (19,5 μmol/l), co nastąpiło po trzech miesiącach od początku choroby.
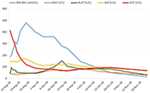
Rysunek 3. Przebieg bilirubiny i enzymów wątrobowych w czasie.
Przypadek zgłoszono do jednostki nadzoru nad bezpieczeństwem farmakoterapii szwajcarskiego krajowego urzędu ds. produktów leczniczych (Swissmedic). Od uczestnika uzyskano pisemną świadomą zgodę na publikację tego opisu przypadku.
Dyskusja
Pochodne artemizyny są podstawą leczenia, ale nie chemoprewencji malarii (2). Pomimo ich szerokiego zastosowania, rzadko opisywano uszkodzenia wątroby wywołane przez pochodne artemizyny (8, 10). O ile nam wiadomo, jest to pierwszy opis przypadku ostrego cholestatycznego zapalenia wątroby spowodowanego spożyciem herbaty Artemisia annua.
Ziołowe i dietetyczne suplementy -indukowane uszkodzenie wątroby jest tematem budzącym coraz większe zainteresowanie, ponieważ HDS są coraz częściej stosowane na całym świecie (7). Przyjmowanie HDS jest często uważane za nieszkodliwe, jednak odnotowuje się coraz większą liczbę zdarzeń niepożądanych występujących wraz z ich stosowaniem (16). Ponadto, ponieważ stężenie i skład HDS często nie są deklarowane na etykietach produktów, jakość i ilość składników produktu pozostaje nieznana. W naszym przypadku rozpoznanie uszkodzenia wątroby wywołanego HDS w związku z przyjmowaniem herbaty Artemisia annua było oparte na silnym związku czasowym między ekspozycją a rozwojem reakcji niepożądanej oraz na braku innych możliwych etiologii. Obliczyliśmy wynik oceny przyczynowości zgodnie z metodą RUCAM (Roussel Uclaf Causality Assessment Method) (17) i uzyskaliśmy wynik 6 odpowiadający „prawdopodobnej” przyczynowości inkryminowanego leku. Poszczególne pozycje były punktowane w następujący sposób: czas do wystąpienia (+2), przebieg (+1), czynniki ryzyka (+1), jednocześnie stosowane leki (-1), wykluczenie innych przyczyn uszkodzenia wątroby (+2), wcześniejsze informacje o hepatotoksyczności leku (+1), odpowiedź na ponowne podanie (0). Nie było innych możliwych do zidentyfikowania etiologii choroby wątroby.
Przypadek opisany wcześniej przez Kumara przedstawiał wątrobowokomórkowy wzór uszkodzenia wątroby, po którym nastąpiła przedłużona faza cholestatyczna (10). U naszego pacjenta wystąpił głównie cholestatyczny obraz uszkodzenia wątroby 5 tygodni po pierwszym spożyciu herbaty Artemisia annua. Zakładamy, że historia naturalna była podobna do przypadku Kumara, ale nasz pacjent zgłosił się w późniejszym stadium rozwoju uszkodzenia wątroby. W analizie toksykologicznej spożytej herbaty ziołowej zidentyfikowaliśmy dodatkowo skopoletynę i kamforę, które naturalnie występują w Artemisia annua (18, 19) i mogły przyczynić się do początku cholestatycznego uszkodzenia wątroby.
Mechanizm uszkodzenia wątroby wywołanego pochodnymi artemizyny pozostaje niejasny. Składniki chemiczne Artemisiae spp obejmują olejki lotne, flawonoidy, taniny, triterpeny i polisacharydy. Lotne olejki z Artemisiae spp mają silną aktywność farmakologiczną i toksyczność, a ostatnie podejście bioinformatyczne zidentyfikowało różne szlaki, które mogą być zaangażowane w rozwój uszkodzenia wątroby (20). Predyspozycja do wywołanego lekami cholestatycznego uszkodzenia wątroby została powiązana z polimorfizmami pompy eksportu soli żółciowych (21, 22). Dlatego poszukiwaliśmy wariantów w transporterach kwasów żółciowych za pomocą sekwencjonowania następnej generacji. Nie wykryliśmy delecji, duplikacji lub patologicznego wariantu w sekwencjach genów ABCB11, ATP8B1 i ABCB4 (regiony kodujące i flankujące) kodujących odpowiednio BSEP, FIC1 i MDR3 (Figura 4). Zidentyfikowano jednak szereg wspólnych wariantów sekwencji. U naszej pacjentki homozygotycznie występował wariant genu ABCB11. Dyskutowano, czy ten polimorfizm jest związany z łagodną, nawracającą i/lub postępującą znaną cholestazą wewnątrzwątrobową i wewnątrzwątrobową cholestazą ciężarnych (23, 24). Ponadto, inny wspólny wariant w genie ABCB11 został wykryty w stanie heterozygotycznym. Wariant ten był związany z obniżoną ekspresją białka (25) oraz z pierwotną żółciową marskością wątroby (26, 27). Jednak oba warianty genetyczne są zdecydowanie zbyt częste w populacji ogólnej, aby mogły być przyczyną cholestatycznych chorób wątroby (28). Systematyczne sekwencjonowanie transkryptomu w takich przypadkach może zidentyfikować warianty w innych regionach sekwencji genów lub w innych genach kodujących inne transportery wątrobowe lub białka zaangażowane w wytwarzanie żółci, takie jak ABCC2, ABCC3, ABCC4 i białko ścisłego połączenia 2 (TJP2), odpowiednio (21).
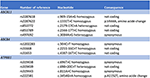
Rysunek 4. Molekularna analiza genetyczna genów ABCB11, ABCB4 i ATP8B1.
Podsumowując, opisujemy przypadek ciężkiego cholestatycznego uszkodzenia wątroby wywołanego HDS, zgodnego z przyjmowaniem herbaty Artemisia annua. Należy podjąć starania, aby zniechęcić do stosowania pochodnych artemizyny w profilaktyce malarii, która zgodnie z zaleceniami WHO jest nieskuteczna, a dodatkowo może szkodzić. Ponadto przypadek ten wskazuje na nasze dotychczasowe niedostateczne zrozumienie patofizjologii i podatności na uszkodzenie wątroby wywołane HDS.
Oświadczenie o dostępności danych
Wszystkie zestawy danych do tego badania są zawarte w manuskrypcie/plikach uzupełniających.
Oświadczenie o etyce
Przegląd etyczny i zgoda nie były wymagane do zgłoszenia pojedynczego przypadku klinicznego tutaj zgodnie z lokalnym ustawodawstwem i wymaganiami instytucjonalnymi. Pacjent/uczestnik udzielił pisemnej świadomej zgody na udział w badaniu.
Wkład autorów
FR-R napisał pierwszy projekt manuskryptu. SH, CB, AL-T, MZ i AJ napisali części manuskryptu. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT, and CB contributed to the clinical management of the patient, manuscript revision, read and approved the submitted version.
Konflikt interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
1. Klayman DL. Qinghaosu (artemizynina): lek przeciwmalaryczny z Chin. Science. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Światowa Organizacja Zdrowia. WHO Guidelines for the Treatment of Malaria, 2nd ed. (2010). Dostępne online pod adresem: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (dostęp 23 listopada 2018 r.).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Dostępne online na: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (dostęp 23 listopada 2018 r.).
Google Scholar
4. Centers for Disease Control and Prevention. Choosing a Drug to Prevent Malaria (2018). Dostępne online na: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Artesunate misuse and Plasmodium falciparum malaria in traveler returning from Africa. Emerg Infect Dis. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Światowa Organizacja Zdrowia. WHO, stanowisko. Effectiveness of Non-Pharmaceutical Forms of Artemisia annua L. Against Malaria. Genewa: Światowa Organizacja Zdrowia (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Liver injury from herbal and dietary supplements. Hepatology. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Dwa przypadki piorunującego zapalenia wątroby podczas leczenia leczniczego połączeniem artesunatu i amodiaquiny. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centers for Disease Control and Prevention (CDC). Zapalenie wątroby czasowo związane z suplementem ziołowym zawierającym artemizynę – Waszyngton, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Cholestatyczne uszkodzenie wątroby wtórne do artemizyniny. Hepatology. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. Pilotażowe, randomizowane, kontrolowane placebo badanie kliniczne mające na celu zbadanie skuteczności i bezpieczeństwa ekstraktu z Artemisia annua podawanego przez 12 tygodni w celu opanowania bólu, sztywności i ograniczeń funkcjonalnych związanych z chorobą zwyrodnieniową stawu biodrowego i kolanowego. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Potential Risk of Harm to the Liver -Statement Under Section 98 of the Medicines Act 1981 (2018). Dostępne online na: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, Clinical and Research Information on Drug-Induced Liver Injury. Artemisinin Derivatives. (2019). Dostępne online na: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoksyczność z naturalnym suplementem diety, Artemisia annua L. Extract in Grapeseed Oil. New Zealand Pharmacovigilance Centre Reports. Drug Safety (2018). W: 18th ISoP Annual Meeting „Pharmacovigilance without borders.” Genewa (dostęp 11-14 listopada 2018 r.).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Guidelines for the Diagnosis and Management of Herb-Induced Liver Injury. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Trendy w stosowaniu komplementarnych metod zdrowotnych wśród dorosłych: Stany Zjednoczone, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM w uszkodzeniu wątroby wywołanym przez leki i zioła: aktualizacja. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Differences in chemical constituents of Artemisia annua L from different geographical regions in China. PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variations in antimalarial components of Artemisia annua Linn from three regions of Uganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Molecular network-based analysis of the mechanism of liver injury induced by volatile oils from Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. Interference with bile salt export pump function is a susceptibility factor for human liver injury in drug development. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Aktualizacja na temat postępującej rodzinnej cholestazy wewnątrzwątrobowej. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy. Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. The role of the sodium-taurocholate cotransporting polypeptide (NTCP) and of the bile salt export pump (BSEP) in physiology and pathophysiology of bile formation. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. BSEP and MDR3 haplotype structure in healthy Caucasians, primary biliary cirrhosis and primary sclerosing cholangitis. Hepatology. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Wariacje genów ABCB4 i ABCB11 są związane z pierwotną kamicą wewnątrzwątrobową. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. Sequencing of FIC1, BSEP and MDR3 in a large cohort of patients with cholestasis revealed a high number of different genetic variants. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
.