1. Przepuszczalność
2. płynność
3. niejednorodność
– wewnętrzna
– zewnętrzna
– zginanie, grubość
Funkcje błon komórkowych są zdeterminowane przez ich skład molekularny. Rodzaj i proporcje tych cząsteczek będą wyznaczać cechy fizykochemiczne błon: półprzepuszczalność, asymetrię, płynność, naprawę i recykling.
Przepuszczalność
Półprzepuszczalność błon jest konsekwencją wewnętrznego hydrofobowego środowiska błon, tworzonego przez lipidowe łańcuchy kwasów tłuszczowych, które jest trudne do przekroczenia przez cząsteczki posiadające ładunki elektryczne. Tak więc, zapobiegaj±c swobodnej dyfuzji cz±steczek, błony mog± tworzyć przedziały, które zachowuj± odrębne ¶rodowisko wewnętrzne i zewnętrzne. Jednakże, przepuszczalność jest selektywna. Polarność i rozmiar są ważniejszymi cechami molekularnymi, które wpływają na zdolność do przekraczania membran. Małe cząsteczki bez ładunków elektrycznych, takie jak CO2, N2, O2 i cząsteczki o wysokiej rozpuszczalności w tłuszczach, takie jak etanol, mogą przekraczać błony prawie swobodnie poprzez dyfuzję pasywną (rysunek 1). Przepuszczalność jest mniejsza dla cząsteczek, które mają ładunki elektryczne, gdy liczba ładunków dodatnich jest równa ładunkom ujemnym, znanych jako cząsteczki nienaładowane, takie jak woda i glicerol. Można by pomyśleć, że woda może swobodnie przekraczać błony, ale istnieją pewne ograniczenia i dlatego niektóre błony zawierają akwaporyny, rodzaj białek transmembranowych z kanałami, które pozwalają wodzie swobodnie przekraczać błony. Zdolność dużych, nienaładowanych cząsteczek, takich jak glukoza, do przekraczania błon jest niewielka. Membrany są wysoce nieprzepuszczalne dla jonów i naładowanych cząsteczek. Niektóre wartości współczynnika przepuszczalności na drodze dyfuzji biernej to: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glicerol: 10 -6 cm/s, sód i potas: 10 -14 cm/s.
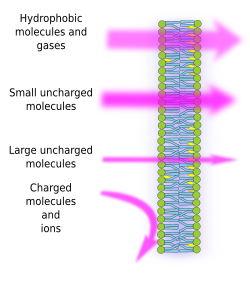
Nierównomierne rozmieszczenie jonów i cząsteczek po obu stronach błony umożliwia wytworzenie i utrzymanie gradientów elektrochemicznych. Różnica pomiędzy wewnętrzną i zewnętrzną koncentracją ładunków elektrycznych nazywana jest potencjałem membranowym. Gradient ten jest wykorzystywany do wielu funkcji komórki, takich jak synteza ATP i przekazywanie informacji wzdłuż nerwów. Semiprzepuszczalność jest również odpowiedzialna za procesy osmotyczne, które polegają na przemieszczaniu się wody przez błony z mniej stężonego roztworu po jednej stronie do bardziej stężonego roztworu po drugiej stronie, w celu wyrównania obu stężeń. W ten sposób komórki roślinne mogą zwiększać swoje rozmiary dzięki wyższemu wewnątrzkomórkowemu stężeniu niektórych rozpuszczalników, które powodują wnikanie wody do wnętrza komórki, co z kolei wytwarza wewnętrzne ciśnienie hydrostatyczne (zwane ciśnieniem turgoru), które wypycha ściany komórkowe na zewnątrz. Cząsteczki, które nie przekraczają swobodnie błon, są użyteczne dla komórek, ponieważ mogą tworzyć gradienty, które mogą działać jako mechanizmy informacyjne lub jako magazyny energii. Komórki posiadają białka transmembranowe, które pozwalają na przekraczanie błony lub przenoszenie naładowanych cząsteczek i jonów pomiędzy obiema stronami błony komórkowej, unikając hydrofobowego środowiska błony wewnętrznej. Na przykład, skurcz mięśnia jest wyzwalany przez otwarcie kanałów, które zmniejszają istniejący gradient jonowy.
Na semiprzepuszczalność wpływa skład lipidowy błon. Na przykład, zawartość cholesterolu jest ważna w błonie plazmatycznej. Wzrost zawartości cholesterolu zmniejsza płynność i zwiększa hydrofobowość, obie cechy sprawiają, że błona jest bardziej nieprzepuszczalna. Tak więc, wzrost zawartości cholesterolu powyżej 30% (co jest wysoką wartością) sprawia, że błony mielinowe są bardzo odpowiednie do izolowania aksonów i optymalizacji propagacji potencjału czynnościowego wzdłuż aksonu.
Płynność i domeny boczne
Płynność jest właściwością błon. Jest ona związana ze zdolnością cząsteczek do poruszania się wewnątrz błon. Większa płynność oznacza, że ruchy są częstsze. Błony komórkowe są w rzeczywistości arkuszem tłuszczu, w którym cząsteczki znajdują się w półpłynnym stanie lepkości. Można się więc domyślać, że cząsteczki mogą się przemieszczać na drodze dyfuzji. Na przykład, glicerofosfolipid znajdujący się w zewnętrznej monowarstwie błony plazmatycznej może mieć dwa rodzaje ruchów: lateralny, czyli w tej samej monowarstwie, i flip-flop, czyli przeskakiwanie z jednej monowarstwy do drugiej (rysunek 2). W sztucznych membranach zaobserwowano te dwa rodzaje ruchów, przy czym ruchy poprzeczne są znacznie częstsze niż flip-flop. Dzięki dyfuzji bocznej lipidy mogą przebyć drogę 30 µm w ciągu 20 sekund; w ciągu minuty mogą przebyć cały obwód średniej wielkości komórki. Jednak ruchy typu flip-flop są naprawdę rzadkie, ponieważ hydrofilowa głowa cząsteczki lipidu musi przekroczyć wewnętrzną warstwę łańcuchów kwasów tłuszczowych, a jest to termodynamicznie trudne. Dla jednej cząsteczki lipidu prawdopodobieństwo przesunięcia klapki wynosi około jeden raz na miesiąc. Jednak cholesterol zachowuje się inaczej i może zrobić flip-flop dość łatwo.

Płynność błony może się zmieniać w zależności od składu chemicznego. Generalnie, krótsze łańcuchy kwasów tłuszczowych i większa ilość nienasyconych wiązań między karbonami kwasów tłuszczowych zwiększają płynność błony. Ilość cholesterolu również wpływa na płynność błony, ale efekt netto zależy od temperatury i rodzaju lipidów w błonie. Cholesterol ma dwa efekty: hamuje przejście do stanu stałego żelu (mniejsza płynność), ale także zmniejsza elastyczność łańcuchów nienasyconych kwasów tłuszczowych. Ogólnie można powiedzieć, że wzrost stężenia cholesterolu zmniejsza płynność błony, choć w niskich temperaturach efekt ten jest odwrotny. Błony wewnętrzne komórki, takie jak te w retikulum endoplazmatycznym, zawierają bardzo mało cholesterolu i dlatego są bardziej płynne. Ponadto, cholesterol zapewnia membranom inną właściwość znaną jako hidrofobowość, która sprawia, że membrany są bardziej nieprzepuszczalne.
Różny skład molekularny pomiędzy dwoma monowarstwami błony, znany jako asymetria błony, może generować odrębną płynność w każdej monowarstwie. W zależności od składu molekularnego, lipidy mogą znajdować się w dwóch fazach fizycznych: uporządkowanej (mniejsza płynność) i nieuporządkowanej (większa płynność). Przypuszcza się, że zewnętrzna monowarstwa błony plazmatycznej częściej znajduje się w fazie ciekło-uporządkowanej, podczas gdy wewnętrzna monowarstwa ma skłonność do bycia w fazie ciekło-nieuporządkowanej.
Komórki mogą modyfikować płynność błon poprzez zmianę ich składu chemicznego. Na przykład, bakterie dostosowują nasycenie i długość łańcuchów kwasów tłuszczowych tak, że płynność błony może być dostosowana do warunków środowiska. Różnice w stężeniu glicerofosfolipidów, takich jak fosfatydyloetanoloamina, mogą również modulować płynność. Niektóre owady nie potrafią syntetyzować steroli, takich jak cholesterol, a sterole w ich błonach pochodzą z pożywienia. Zmieniają one płynność swoich błon komórkowych poprzez różne stężenia fosfatydyloetanoloaminy.
Wewnętrzna błona mitochondriów musi być silną nieprzepuszczalną barierą, aby stworzyć i utrzymać gradient protonów. Można to zrobić poprzez zwiększenie zawartości cholesterolu. W ten sposób hidrofobowość jest większa, ale z kolei cholesterol zmniejsza płynność, która wydaje się być bardzo ważna dla funkcji białek w tej błonie. Mitochondria rozwiązują ten problem za pomocą kardiolipiny, nienasyconego fosfolipidu, który zwiększa hidrofobowość, ale nie zmniejsza znacznie płynności błony.
3. Heterogeniczność
Ze względu na płynność można sądzić, że białka są rozmieszczone losowo i dlatego błony są homogeniczne pod względem składu molekularnego, tzn. wykazują taką samą zawartość molekularną i proporcje niezależnie od regionu błony. Nie jest to prawdą. Istniej± ograniczenia w bocznej dyfuzji cz±steczek, które powoduj± heterogenno¶ć błony, co oznacza, że istniej± regiony błony o różnym składzie molekularnym. W komórkach niespolaryzowanych i w skalach większych niż 200 nm błona plazmatyczna wygl±da jak jednorodna, ale w skalach poniżej 200 nm jest heterogeniczna. Uważa się, że mikrodomeny membran mają wielkość około 60 µm. Lipidy i białka wykazują w ciągu kilku milisekund ruchy boczne ograniczone głównie do obszarów 60-200 nm, a następnie przeskakują do innego sąsiedniego obszaru, gdzie pozostają przez kolejny krótki czas. Takie zachowanie nazywamy dyfuzją saltacyjną.
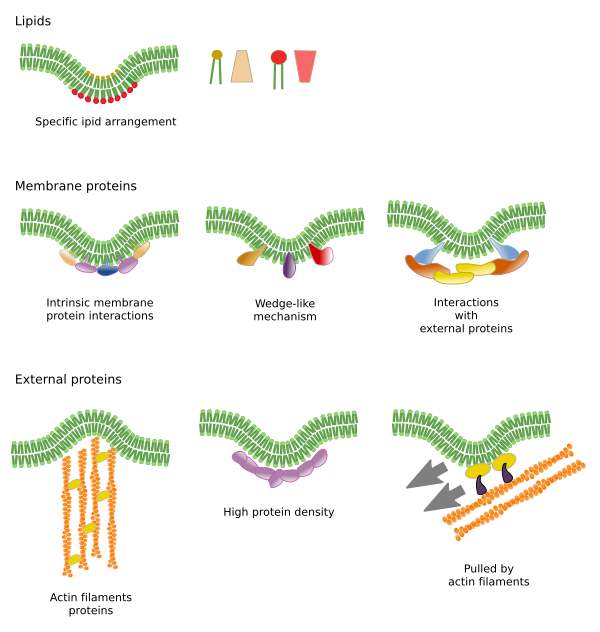
Ograniczenia w bocznych ruchach cząsteczek mogą być spowodowane kilkoma mechanizmami: oddziaływaniami z cytoszkieletem lub macierzą zewnątrzkomórkową, oddziaływaniami cząsteczek błony między sobą, różną gęstością lokalnych obszarów błony (zmiany płynności), ilością ładunków elektrycznych, krzywizną błony i różną grubością domen błony (rysunek 3).
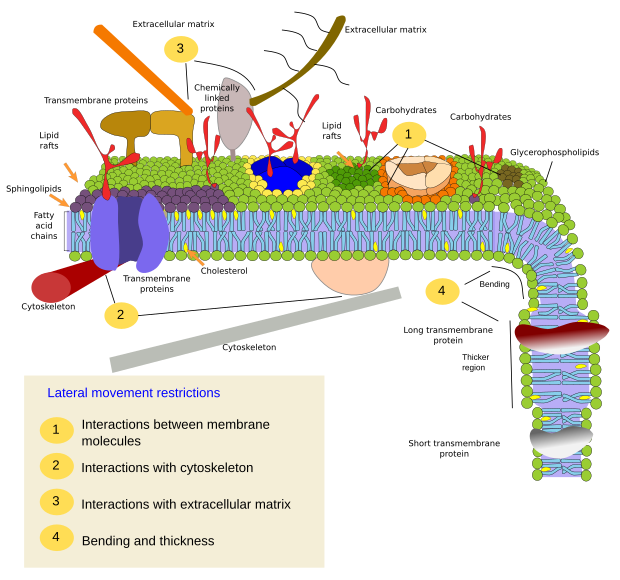
Interakcje wewnętrzne
Interakcje cząsteczek błony między sobą ograniczają ruchy boczne. Zarówno białka jak i lipidy są pod wpływem tych oddziaływań, co prowadzi do powstawania mikrodomen o zróżnicowanym składzie molekularnym (Rysunek 4). Wynikiem tego jest boczne, heterogeniczne rozmieszczenie cząsteczek w błonach. W zależności od proporcji molekularnych, mikrodomeny lipidowe mogą mieć różną gęstość (czyli płynność): stałą, ciekłą uporządkowaną i ciekłą nieuporządkowaną. Najczęstszą gęstością jest ciecz nieuporządkowana, która jest najbardziej płynna.
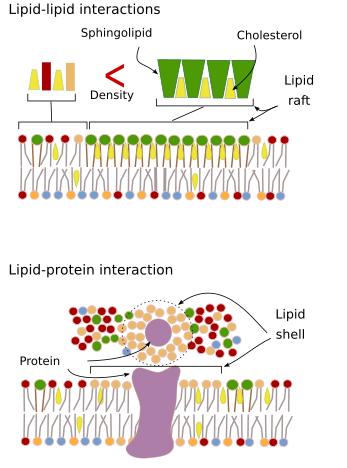
Sfingolipidy i cholesterol mogą spontanicznie wiązać się między sobą, zmniejszając ich ruchliwość i zwiększając gęstość molekularną w porównaniu z sąsiednimi obszarami. Powstaje wtedy mała, odrębna grupa cząsteczek, przypominająca tratwę w morzu lipidów. W rzeczywistości te molekularne asocjacje znane są jako tratwy lipidowe i uważa się, że występują one bardzo obficie w błonach komórkowych. Tratwy lipidowe wykazują bardzo dynamiczne zachowanie, mogą się przemieszczać, rosnąć, maleć, pojawiać się i znikać. Istotnie, błony składają się z wielu gęstych domen przemieszczających się poprzecznie pomiędzy glicerofosfolipidami, tak że błony są dość heterogeniczne pod względem ich molekularnego rozmieszczenia. Niektóre eksperymenty sugerują, że pewne typy białek „czują się” bardziej komfortowo wewnątrz tratw lipidowych. Białka te spędzaj± więcej czasu wewn±trz niż na zewn±trz tratw lipidowych, a więc podróżuj± przez pewien czas wewn±trz tych zagęszczeń. Powoduje to segregację cząsteczek wzdłuż błony i zwiększa prawdopodobieństwo, że różne cząsteczki będą w pobliżu siebie dłużej niż przez przypadek (dyfuzja), zwiększając w ten sposób prawdopodobieństwo pewnych reakcji molekularnych. Ponadto sugeruje się, że wysokie stężenie pewnych typów lipidów w tratwach lipidowych tworzy odrębne środowisko chemiczne, które ułatwia niektóre reakcje chemiczne lub interakcje molekularne. Proponuje się, aby tratwy lipidowe były obecne w zewnętrznej monowarstwie błony plazmatycznej, ponieważ to właśnie po tej stronie znajduje się duża ilość sfingolipidów. Sugeruje się, że domeny błonowe istnieją również w błonach organelli i uważa się, że niektóre z ich funkcji opierają się na tych domenach błonowych.
W wewnętrznej monowarstwie błony plazmatycznej mikrodomeny powstają w wyniku oddziaływań elektrostatycznych pomiędzy podstawowymi domenami cytozolowymi lub domenami kationów dwuwartościowych białek i ujemnymi głowami polarnymi lipidów. Innym, mniej znanym przykładem jest asocjacja pomiędzy bisfosforanem fosfatydyloinozytolu i cholesterolem, która tworzy mikrodomeny w tej monowarstwie. Te mikrodomeny zwrócone w stronę cytozolu mogą wpływać na wewnątrzkomórkowe rusztowania białkowe.
Tradycyjnie uważano, że nie ma żadnych interakcji między obiema monowarstwami błon i że rozmieszczają one swoje mikrodomeny niezależnie. Jednakże, dowody sugerują, że istnieją interakcje między sobą. Białka transbłonowe oddziałuj± jednocze¶nie na obie monowarstwy, ponieważ przekraczaj± one cał± błonę. Inny sposób synchronizacji pomiędzy obiema monowarstwami może być pośredniczony przez długie łańcuchy kwasów tłuszczowych, jak niektóre sfingolipidy, które mogą mieć długość 24 karbonów (normalna długość to 18). Te długie łańcuchy mogą być wstawione pomiędzy łańcuchy kwasów tłuszczowych lipidów drugiej monowarstwy i wpływać na rozkład lipidów. Ponadto, domeny lipidowe z długimi łańcuchami kwasów tłuszczowych są uważane za równoważone przez krótkie łańcuchy kwasów tłuszczowych mikrodomeny lipidowe w drugiej monowarstwie, utrzymując stałą grubość membrany.
Białka błonowe, zarówno integralne jak i związane, mogą również oddziaływać między sobą i składać się w makromolekularne rusztowania, aby ułatwić przekazywanie informacji, komórka-komórka rozpoznanie, rozpocząć niektóre działania enzymatyczne i ruch komórkowy. Istnieją również białka multimeryczne, które są aktywne tylko wtedy, gdy wszystkie podjednostki są trzymane razem. Na przykład, receptor insuliny składa się z czterech podjednostek. Białka i lipidy mogą również wchodzić w interakcje tworząc domeny błonowe. Na przykład, w wewnętrznej monowarstwie, fosfatydyloinozytol kojarzy się wokół białek poprzez interakcje elektryczne, które mogą być regulowane modyfikując fosforany polarnej głowy lipidów.
Interakcje z elementami zewnętrznymi
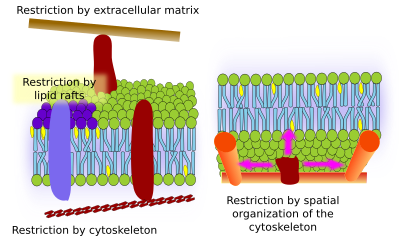
Integralne białka błonowe mogą również mieć ruchy boczne, ale są one bardziej ograniczone niż lipidy, głównie ze względu na interakcje z macierzą zewnątrzkomórkową i cytoszkieletem poprzez ich domeny zewnątrzkomórkowe i wewnątrzkomórkowe, odpowiednio (rysunek 5). Oddziaływania te mogą utrzymywać białka w małych obszarach błony przez dłuższy czas niż tylko przez dyfuzję. Cytoszkielet może tworzyć płoty tuż pod błoną plazmatyczną, które utrzymują białka ograniczone w małych obszarach. Filamenty aktynowe i mikrotubule mog± zamykać małe obszary ograniczaj±c dyfuzję białek i lipidów. Interakcje z cytoszkieletem są ważne, ponieważ jeśli cytoszkielet jest eksperymentalnie zdezorganizowany, błona staje się znacznie bardziej jednorodna. Komórki mają też inne mechanizmy ograniczania białek do określonych domen. Na przykład, w komórkach nabłonka jelitowego niektóre transportery i enzymy s± zlokalizowane w apikalnej błonie plazmatycznej, ale nie w domenie podstawno-bocznej, ponieważ pas ciasnych poł±czeń, molekularny zamek błyskawiczny, uniemożliwia dyfuzję pomiędzy domen± apikaln± i podstawno-boczn±. Taka asymetryczna dystrybucja jest niezbędna dla fizjologii komórki nabłonkowej.
Krzywizna błony to kolejny sposób na tworzenie mikrodomen. Zakrzywienie błony może być punktem wyjścia do tworzenia pęcherzyków, rozszerzenia cytoplazmy dla komórkowego rozszerzania, zmiany kształtu lub wzrostu organelli, lub po prostu do rozpoczęcia bariery ograniczającej boczny ruch cząsteczek. Jest to fizyczne ograniczenie przez trójwymiarową dyspozycję lipidów w mniejszym kącie fałdu błony.
Molekularne narzędzia potrzebne do zginania membrany są rekrutowane do specyficznych regionów membrany. Te mikrodomeny mogą mieć specyficzny skład lipidów lub szczególne środowisko ładunku elektrycznego. Fosfoinozytydy (PIPs), głównie PIP2 i PIP3, są lipidami, które przyczyniają się do rekrutacji białek do zginania błony. Są one użytecznymi cząsteczkami, ponieważ ładunek elektryczny i struktura molekularna ich polarnych głów może być łatwo modyfikowana przez reakcje chemiczne. W ten sposób właściwości danego regionu błony mogą się zmieniać w razie potrzeby i rekrutować określone białka. Fosfatydyloseryna jest również w stanie zainicjować mikrodomenę do zginania błony, gdy jest translokowana z jednej monowarstwy do drugiej przez flipazę.
Zginanie i zagęszczanie
Mikrodomeny lipidowe rekrutują białka, które skutecznie zginają błonę. Istnieją wyspecjalizowane w tej roli białka (Rycina 6). Jednym z nich są białka z domeną BAR (Bin/amfifizyna/Rsv161). Zginanie może być wywoływane przez dwa mechanizmy: składanie zakrzywionego rusztowania białek, które ciągną lub pchają błonę, oraz przez wstawianie sekwencji aminokwasowych pomiędzy lipidy w postaci klina. Na przykład, kaweoliny powodują zakrzywienie błony tworząc kaweole, tetraspainy zmuszają błony do tworzenia tubul, ESCRT pomaga w formowaniu pęcherzyków wewnątrz endosomów tworząc ciała wielopęcherzykowe. Aktyna jest silnym czynnikiem zginaj±cym błonę poprzez polimeryzację filamentu aktynowego, który wypycha błonę plazmatyczn± na zewn±trz, prowadz±c do rozszerzania się komórek. Wiele białek, które mogą zakrzywiać błonę plazmatyczną, aktywuje również polimeryzację aktyny.
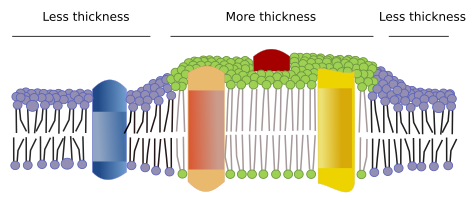
W błonach istnieją inne domeny, domeny fizyczne, utworzone przez cząsteczki takie jak białka transmembranowe. Obszary te wykazują inną grubość błony, ponieważ zawierają białka o dłuższych hydrofobowych sekwencjach aminokwasów, które zostają otoczone przez lipidy o dłuższych łańcuchach kwasów tłuszczowych (rysunek 7). Te białka i lipidy „czują się” bardziej komfortowo, gdy są razem, ponieważ odpowiednio dopasowują swoje hydrofobowe części. Tworzą one domeny membranowe, które wykluczają inne cząsteczki, albo białka lub lipidy, z krótszymi regionami hydrofobowymi.
Bibliografia
Honigmann A, Pralle A. (2016). Compartmentalization of the cell membrane. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Membrane curvature in cell biology: an integration of molecular mechanisms. Journal of cell biology. 214: 275-387.
Subczyński WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). High cholesterol/low cholesterol: effects in biologicalmembranes: a review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.