Introduction
<8734>世界保健機関によると、うつ病は世界中で推定3億5000万人に影響を与えています(Organization, 2017)。 うつ病の患者は不安障害の症状を示し、喜びや興味を経験できない、集中力の低下、自責の念、社会不安、睡眠障害、食欲障害を伴う(Namola et al.、2015)。 うつ病を引き起こす主な要因は、脳内の化学物質やホルモンのアンバランスです。 うつ病に関連する主なホルモンはセロトニンです。 その他のホルモンは、ノルエピネフリンとドーパミンです(Yi et al.、2008)。 これらのホルモンは、脳の機能を正常に保ち、感情をコントロールするために必要なものです。 これらのホルモンが破壊されると、脳内の化学物質のバランスが崩れ、うつ病になる可能性があります。
うつ病は、その重症度に応じて、心理療法や薬物療法で治療することができます。 抗うつ剤は、うつ病の治療に用いられる主な薬物の種類です。 抗うつ薬には多くの種類があり、脳への作用の仕方、コスト、副作用のプロファイルなどが異なるだけです。 第一線の治療では、ほとんどの患者さんが三環系抗うつ薬(TCA)か選択的セロトニン再取り込み阻害薬(SSRI; McCarthy et al.、2016)を処方されます。 不安治療によく使われる薬剤はベンゾジアゼピン系である。 うつ病の治療に用いられる抗うつ薬は市場に多く出回っているが、これらの薬を使用した際の後遺症が懸念される(Binfaré et al.) うつ病の代替療法として、漢方薬の使用があります(Fajemiroye et al.、2016)。 ハーブエキスの使用は、医療関係者や患者の間で広く受け入れられるようになってきています。 うつ病の治療に利用される生薬の大半は、粗製または半精製エキスである(Calixtoら、2000;Carlini、2003;Guan and Liu、2016)<6990><8734>中枢神経系(CNS)に対する活性を誘導できる活性原理に関わる研究報告が乏しい。 Carlini(2003)による総説では、精神神経症状、精神弛緩作用、精神錯乱作用に関する情報のみである。 Guan and Liu(2016)による最近の総説では、天然および合成源から単離されたフラボノイドの抗うつ作用の構造活性相関が論じられています。 合成インドールアルカロイド、その活性、および医学における潜在的な使用については、すでにいくつかの論文でレビューされている(de Sa et al.、2009)。 しかし、単離された植物インドールアルカロイドと抗うつ活性を関連付けた総説は発表されていない。 本総説では、天然インドールアルカロイドの神経疾患治療への可能性、構造活性相関研究、他の生理活性代謝物との関連性などについて、化学構造の観点から抗うつ薬のリード化合物となりうる情報を提供している。
Antidepressant Plants
本総説では、中枢神経系に活性を有する植物を取り上げる。 多くの種類の植物がこのカテゴリーに分類されますが、ここでは抗うつ作用を示す植物にのみ注目します。 インドールアルカロイドを含む植物はPassiflora incarnata L.(パッションフラワー)とMitragyna speciosa (Korth.) Havil(クラトム)の2つであり、インドールアルカロイドの存在を示さなかったPiper methysticum G. Forst(カヴァ)とValeriana officinalis L. が特に注目すべき植物である。 これらの植物から単離された化合物の化学構造は、新薬開発の基礎として利用できる。
Passiflora incarnataやP. alata Curtis, P. coerulea L. and P. edulis Simsなどの他の種は、ほとんどのヨーロッパ諸国やアメリカで伝統医学において鎮静剤として広く使用されている(Houghton and Seth, 2003)。 ベンゾジアゼピン系薬物の構造は、ベンゼン環が、環の1位と2位に2つの窒素原子を有する7員複素環部分からなるジアゼピン系に縮合したものである。 P. incarnataから単離されたインドールアルカロイドすなわちharman、harmol、harmine、harmalolおよびharmalineは、1つの窒素原子を含む5員複素環に融合したベンゼン環からなる。
いくつかの研究は、P. incarnataがベンゾジアゼピンと同様の薬理プロファイルを持ち、ガンマ-アミノ酸(GABA)受容体を通して作用すると指摘してきた(Jawna-Zboiñska et al, 2016)。 M. speciosaの葉は、下痢や糖尿病の治療、血液循環の改善に伝統的な薬として使用されてきました(Vicknasingam et al.、2010)。 ミトラギニンは、M. speciosaに存在する主要なインドールアルカロイドであり、その類似体であるスペシオギニン、ペイナンテイン、スペシオシリアティンがある(León et al.、2009)。 M. speciosaの水性エキスとアルカロイドエキスについて行われた2つの研究は、行動的絶望感のマウスモデルに対して抗うつ剤様効果を誘発しました (Kumarnsit et al.、2007年)。 Idayuら(2011)が行ったミトラギニンに関する研究では、うつ病の動物行動モデルにおいて、神経内分泌系の視床下部-下垂体-副腎(HPA)軸との相互作用を通じて、抗うつ薬の効果を示す(Idayuら、2011)<6990><8734>Piper methysticum G. Forstはカバという飲み物として摂取され、疲労や不安を軽減しつつ明るい気分に向かって快い精神状態を誘発する(Billaら、2002)。 この研究では、水溶性抽出物と比較して、脂溶性抽出物からほとんどの薬理活性が保持されていることが示された。 脂溶性抽出物には、カバラクトンとして知られるピロン類が少なくとも7種類含まれている。 カバラクトンは、一般に、ドーパミン神経系、セロトニン、ガンマアミノ酪酸(GABA)、グルタミン酸神経伝達と相互作用し、モノアミン酸化酵素B(MOB)を防ぎ、またイオンチャンネルに様々な作用を与える(Grunzeら、2001年)。 ジヒドロメチシンは、カバノキに含まれる6つの主要なカバラクトンのうちの1つである。 ジヒドロメチシンの構造は、アリールエチレン-α-ピロンに、窒素の代わりに2つの酸素からなるインドール様部位が結合したものである。 抗不安作用に寄与し、抗うつ薬として作用する。 二重盲検プラセボ対照試験により、kavalactonesは精神および運動機能を低下させることなく抗不安作用を示し、睡眠の質を向上させることが実証された。 カバラクトン類は、うつ病治療におけるベンゾジアゼピン類の使用に代わる代替薬である(Malsch and Kieser, 2001)。
バレリアンとして知られるValeriana officinalis L.は、鎮静剤、抗けいれん剤、催眠効果、抗不安活性として多くの国で広く使用されている(Ghaderi and Jafari, 2014)。 バレレン酸やバレポトリエートは医薬品製剤の有効成分として報告されており、バレリアン市販粗抽出物は多くの国で使用が記録されている(Bosら、2002年)。 ポリヒドロキシシクロペンタ-(c)-ピランとカルボン酸:酢酸、吉草酸、イソ吉草酸、α-イソ吉草酸、β-メチル吉草酸、β-アセトキシ吉草酸及びβ-アセトキシ-β-メチル吉草酸のトリエステルを構成するバレポトリエートは、鎮静剤として使用されています。 バレポトリエートは不安定で熱に弱く、水中やアルコール溶液中の酸性またはアルカリ性条件下で急速に分解する(Bosら、2002年)。 バレポトリエートは、ベンゾジアゼピン離脱中の動物およびヒトの状態を改善するのに有用である(Poyares et al, 2002)。
様々な異なる化学成分があるが、作用機序としては、GABAトランスアミナーゼの阻害によるバレリアンの脳内GABA系との相互作用、GABA受容体・ベンゾジアゼピンとの相互作用、シナプトソームへのGABAの取り込み・取り込みの阻害が報告されている(Sichardt et al.,2007)。 植物の抗うつ作用を調べるために、様々なモデルが利用されてきた。 薬力学的モデルには、in vitro、in vivo、臨床モデルなどがあり、効果を評価するために利用された(表1)。 レビューした植物種の大半はin vivoレベルで研究され、in vitroでの研究は少数で、臨床試験を受けたのはカバのみであった。 いずれの場合も、活性化合物、最も効果的な投与量を確立し、これが異なるタイプのうつ病間で異なるかどうかを判断するために、さらなる研究を実施する必要がある

TABLE 1. 6990>
インドールアルカロイド
インドールアルカロイドは、6員ベンゼン環が5員窒素含有ピロール環に融合した2環構造である。 この窒素原子を持つピロール環がインドールアルカロイドの基本的な性質を生み出し、特に薬理活性が高い(El-Sayed and Verpoorte, 2007)。 インドールアルカロイドは、セリ科、アカネ科、アカネ科、ルビー科、ナズナ科に属する植物に広く分布している。 植物から単離された重要なインドールアルカロイドには、Rauvolfia serpentinaからの降圧剤、レセルピン(Sagi et al.、2016)、Catharanthus roseusからの強力な抗腫瘍剤、ビンブラスチンおよびビンクリスチン(El-Sayed and Verpoorte、2007)などがあります。 うつ病の治療におけるインドールアルカロイドの有効性に関する研究は新しいものではなく、1952年から行われているが、現在、抗うつ作用を付与された植物の治療上の有用性については、科学界からほとんど注目されていない<6990><8734>インドールアルカロイドは、Gタンパク質受容体の機能、特にセロトニン(5-HT/ヒドロキシトリプタミン)に対する受容体を通じた神経信号伝達に対してしばしば関連している。 遊離のN-Hを介した水素供与体とは別に、π電子密度の存在は、平面的なインドール骨格の最高被占分子軌道(HOMO)エネルギーに寄与している。 これにより、核酸塩基、特にプロトン化した原子や標的タンパク質との相互作用が可能になる(de Sa et al.、2009)。 神経伝達物質であるセロトニンの化学構造は、電子が豊富な芳香族インドール環をベースにしている。 インドール環の窒素原子の存在は、芳香族系を維持するためであり、結合するN-Hを窒素塩基性ではなく酸性にする。 インドール環は、N-H部位を介した水素結合と、芳香族部位を介したπ-πスタッキングやカチオン-π相互作用を形成することができる(Shimazaki et al., 2009). インドール環の疎水性はフェニルサブユニットとほぼ同じであり、古典的な等方性ベンゾチオフェン環やベンゾフラン環よりも疎水性が低い。 N-Hインドール基は、合成されたベンゾチオフェンおよびベンゾフラン誘導体が標的バイオレセプターに対して中程度から限られた親和性を示す一方で、標的バイオレセプターとの相互作用において決定的な役割を果たす(de Sa et al.) レセルピンは、過去60年間に単離されたインドールアルカロイドの一例であり、中枢神経系に鎮静作用を示すものである。 ちなみに、脳内に存在するトリプタミンとセロトニンという2つの化学物質もインドールアルカロイド誘導体である。
現在、抗うつ作用の原因となる植物抽出物の活性成分はまだ不明である。 そこで、抗うつ作用を示す植物抽出物から分離されたいくつかの重要な化学構造を同定し、抗うつ作用に寄与すると思われる骨格パターンの類似性を確認することを試みる。 セロトニンとインドールアルカロイドの構造的類似性を確認する試みは、早くから行われている。 最も明確な類似点は、5員環に縮合した6員複素環からなることである。 違いは、窒素原子の有無やπ電子の分布である(図1)。 Nichols(2012)は構造活性相関研究を通じて、分子の種類によって活性が異なることから、受容体がトリプタミンの性質に非常に敏感であることを示唆していると報告しています。 抗うつ植物から単離された他の化合物については、特定の置換パターンを持つ特異的なアゴニストであり、エフェクターのサブセットを選択的に活性化することができるため、この総説で言及した。 この現象は現在、機能的選択性として知られている。
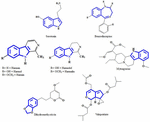
FIGURE 1. セロトニン、ベンゾジアゼピン、抗うつ植物から単離された化合物の化学構造。 6990>
セロトニンは、内因性受容体アゴニストとして脳機能や認知に広く利用されている(Fink and Göthert, 2007)。 セロトニンはGタンパク質共役型受容体に属する7つの受容体ファミリー(5-HT1〜5-HT7)を介してその機能を発揮する。 インドール部分を持つ多くの化合物は、異なるセロトニン受容体に親和性を持つことが報告されている(Kochanowska-Karamyan and Hamann, 2010)。 インドールアルカロイド(外因性作動薬)がセロトニンのような内因性神経伝達物質に構造的に類似していることから、研究者はこれらの分子の潜在的な神経学的活性を予測するようになった。 図 2 に、外因性アゴニストの神経伝達に関するプロセスの模式図を示します。 神経伝達に関連するプロセスの模式図。 セロトニン受容体(5-HT受容体)に結合することができるセロトニンと構造の類似性を共有する植物からのインドールアルカロイドの外因性作動薬
インドール環はバイオイソステアとしても知られ、生体分子と同様の化学および物理を有する。 この類似性を利用して、薬理活性の向上や薬物動態プロファイルの最適化を目的としたプロトタイプ薬剤の開発が行われています。 ベンゾフランとチエノピロールの薬理評価に関する別の研究では、ジメチルトリプタミン様活性を有するバイオイソステア分子を導き出しました。 ベンゾチオフェンと3-インデナルキルアミンを用いた初期の研究では、環状置換基を欠く化合物では、ラット眼底でアゴニストとして作用する能力はトリプタミンと同程度であることが示された。 その結果、ラット眼底の5-HT2受容体の活性化には、インドールNHは必須ではないことが明らかになった(Nichols, 2012)。 一連の2-アリールインドールNK1受容体拮抗薬とその誘導体は、良好なリガンドであるが、ラットにおける経口バイオアベイラビリティは低い。 溶解性と吸収性を高めるために、塩基性窒素が導入され、一連の2-アリールインドールNK1受容体拮抗薬と同じNK1結合親和性を示すアナログアザインドールおよび関連化合物が生まれた( Cooper et al.、2001)。 2つのフェニルインドール由来リガンドとセロトニン5-HT6およびメラノコルチン4受容体の分子ドッキングから、特権的な足場は、自然保存されたサブポケットと非保存結合ポケットによって対応することができることが示された。 結合ポケットの非保存部分の相互作用は、対応する標的受容体による分子認識の重要な違いに関与している(Bondensgaard et al, 2004)。<6990><8734>de Saら(2009)によれば、天然源に見出される一般的なインドールアルカロイドは、人間の栄養におけるトリプトファンアミノ酸、抗炎症などの治療効果を有する植物ホルモンの発見、ホスホジエステラーゼ阻害剤、5-HT受容体作動薬および拮抗薬、カナビノイド受容体作動薬およびHMG-COA還元酵素阻害剤であった。 インドール骨格は結合ポケットを持ち、GPCR(G-protein important membrane receptors coupled)の一種である標的受容体と共通の相補的結合ドメインを有している。 市販されている医薬品の多くはインドール骨格を有している。 インドメタシン、エルゴタミン、フロバトリプタン、オンダンセトロン、タダラフィルなどです。
結論
このレビューで、精神疾患の治療に示された植物由来の治療薬の大部分は、粗製または半精製のものであることがわかりました。 生物地理学的に異なる地域では、植物の二次代謝産物の含有量は、栄養の利用可能性、気候や生態学的条件と相関するため、in vivoとin vitroの結果は異なり、再現性がない。 また、植物の生理活性は、単一の化合物または化合物の混合物によって寄与されている可能性がある。 著者らは、植物由来医薬品の特性をよりよく理解するために、in vitroおよびin vivoでの検査を行い、活性原理の取得、植物化学物質の同定、メタボロミクス研究を実施することを提案している。 インドールアルカロイドの合成は、天然に存在する分子とセロトニンとの類似性にヒントを得て行われたケースが多い
植物由来のインドールアルカロイドは、合成と比べるとかなり複雑である。 合成インドールアルカロイドは、その構造が様々なリガンド受容体、酵素阻害剤、モジュレーター生体受容体に利用できるため、その重要性はすでに確立されています。 天然に存在するインドールアルカロイドの中には、現在知られている方法では合成できないものがあります。 また、インドールアルカロイドの有効性に関する情報のほとんどは、合成インドールアルカロイドから報告されたものである。 そのため、天然に存在する多くのインドールアルカロイドは、様々な精神疾患に対する新薬のリードとなる可能性を持っていますが、まだ未開発の状態です。 歴史的に見ると、植物由来の化合物は、最も成功した創薬リード化合物や医療で使用される薬剤の幾つかを生み出してきたのである。 6990>
結論として、いくつかのインドールアルカロイドは抗うつ薬として採用されているか、その開発のためのリード構造を提供していることがわかった。
Author Contributions
HH: 原稿の準備。 MY:英文校正と、原稿をより良くするための重要な情報の提案。
Funding
本研究はマレーシア・パハン大学より研究助成金UMP RDU170302を受け、HHに提供したものである。
利益相反声明
著者らは、本研究が潜在的な利益相反と解釈されうるいかなる商業的または金銭的関係もない状態で行われたことを宣言する
Bilia, A. R.., Gallori, S., and Vincieri, F. F. (2002). カヴァカヴァと不安:有効性と安全性に関する知識の増加。 Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., and Rodrigues, A. L. S. (2009).のようなものです。 アスコルビン酸投与は抗うつ様効果をもたらす:モノアミン神経伝達の関与の証拠。 Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., and Bywater, R. P. (2004). Gタンパク質共役型受容体による特権構造の認識。 J. Med. Chem. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., and Pras, N. (2002). バレポトリエートの定量 J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., and Yunes, R. A. (2000). 植物由来の天然抗侵害受容性物質. Phytother. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract |Ref Full Text | Google Scholar
Carlini, E. (2003)(2003. 植物と中枢神経系. Pharmacol. Biochem. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L.C., Chicchi, G.G., Dinnell, K., Elliott, J.M., Hollingworth, G.J., Kurtz, M.M.,など (2001). 2-アリールインドールNK 1受容体拮抗薬:インドール置換の最適化。 Bioorg. Med. Chem. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., and Alberto, C. (2009). 自然界から創薬へ:「特権的構造」としてのインドール足場。 Mini Rev. Med. Chem. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., and Verpoorte, R. (2007). Catharanthus terpenoid indole alkaloids: biosynthesis and regulation. Phytochem. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye,J. O., Silva, D. M., Oliveira, D. R., and Costa, E. A. (2016). 不安とうつ病の治療:薬用植物の回顧. ファンダム. Clin. Pharmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., and Weiss, G. (2011). セントジョーンズワート(Hypericum perforatum)とパッションフラワー(Passiflora incarnata)の生薬配合における薬理試験:抗うつ薬理モデルにおけるハイペリカムとパッシフローラ間の相乗効果のin vitroおよびin vivoエビデンス。 Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., and Göthert, M. (2007). 5-HT受容体による神経伝達物質放出の調節. Pharmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., and Jafari, M. (2014). 効率的な植物再生,遺伝的忠実性,および再生植物における2つの医薬化合物の高レベル蓄積 Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., and Walden, J. (2001). Kava pyrones exert effects on neuronal transmission and transmembraneous cation currents similar to established mood stabilizers-a review(カヴァピロンが神経伝達および膜貫通陽イオン電流に及ぼす影響:レビュー)。 Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., and Liu, B.-Y. (2016). フラボノイドおよび関連類似化合物の抗うつ様作用とそのメカニズム. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., and Winterhoff, H. (2008). Valeriana officinalis L. sl の抽出物は、抗不安作用と抗うつ作用を示すが、鎮静作用も筋弛緩作用も示さない。 Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., and Seth, P. (2003). 植物と中枢神経系. Pharmacol. Biochem. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A.、他 (2011). Mitragyna speciosa Korth から単離されたミトラギニンのうつ病モデルマウスにおける抗うつ様作用。 Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K…, Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al.(2016年)。 Passiflora incarnata L. Improves spatial memory, reduce stress, and affects neurotransmission in rats.(パッシフローラ インカルナータL.はラットの空間記憶を改善し、ストレスを軽減し、神経伝達に影響を与える。 Phytother. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., and Hamann, M. T. (2010). 海洋性インドールアルカロイド:うつ病と不安の制御のための新しい薬剤のリードの可能性。 Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., and Intasaro, P. (2007). Mitragyna speciosaのアルカロイド抽出物によって誘発されたラット背側被蓋核のFos様免疫反応。 Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J.E., Furr, E.B., McCurdy, C.R., and Cutler, S.J. (2009). 米国産Mitragyna speciosaの葉の植物化学的特徴づけ。 Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., and Kieser, M. (2001). ベンゾジアゼピン系薬剤による前処置後の非精神病性不安の治療におけるカヴァカヴァの有効性。 Psychopharmacology 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., and Dijk, D.-J. (2016). レム睡眠がない場合のレム睡眠のホメオスタシス。 抗うつ薬の効果. Neuropharmacology 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., and Kothiyal, P.(2015).レム睡眠のない状態におけるレム睡眠恒常性:抗うつ薬の効果。 海洋バイオマテリアルのうつわと役割:レビュー。 Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). セロトニン5-HT 2Aアゴニストの構造活性相関. WIREs Membr. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organization, W. H. (2017). うつ病ファクトシート2016. で入手可能。 http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., and Tufik, S. (2002). バレリアンはベンゾジアゼピン離脱後の不眠症患者の睡眠を改善できるか? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., and Khan, I. A. (2016). 超高速液体クロマトグラフィー-フォトダイオードアレイ-質量分析法を用いたRauwolfia serpentinaの根からのアルカロイドの定量と特性評価。 Anal. バイオアナル。 Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., and Deed, G. (2009 年). Kava Anxiety Depression Spectrum Study (KADSS): a randomized, placebo-controlled crossover trial using an aqueous extract of Piper methysticum. Psychopharmacology 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., and Yamauchi, O. (2009). インドール環が関与する金属錯体:構造と金属-インドール相互作用の効果. コーディネート。 Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A. and Nieber, K. (2007). Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). 半島マレーシア北部の州におけるオピオイド離脱のためのケタム(Mitragyna speciosa)の非公式使用と薬物代替療法への示唆。 Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D.D., and Naidu, M. (2016)(2016. Mitragyna speciosa葉エキスは抗精神病薬様作用を示し、マウスにおける精神病の陽性および陰性症状を緩和する可能性を示した。 Front. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., and Kong, L.-D. (2008). 柑橘類に含まれる化学物質アピゲニンの抗うつ様行動および神経化学的効果。 Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar
.