背景
Artemisia annuaは中国の薬草(別名:青花、甘草)で、抗マラリア活性がよく証明されている(1)。 アルテミシニン誘導体ベースの併用療法(ACT)は、有効な抗マラリア剤との組み合わせで、合併症のないマラリアの治療法として世界保健機関(WHO)により推奨されています(2)。 旅行者に対する化学予防は、マラリアが流行する旅行先によって異なり、アトバクオン/プログアニル、クロロキン、ドキシサイクリン、メフロキン、プリマキンの組み合わせがあります(3、4)。 アルテミシニン誘導体による化学予防下でマラリアに感染した症例が報告されており(5)、WHOは茶を含むいかなる形態のA. annua植物材料をマラリアの治療または予防のために使用することを推奨していない(6)。 マラリア流行地ではACTが広く使用されているにもかかわらず、アルテミシニン誘導体による肝障害はまれである(8、9)。 Kumarは、一般的な健康維持のためにアルテミシニンを含むハーブサプリメントを経口摂取した6週間後に胆汁性肝障害を発症した症例を報告した(10)。 その他、Artemisia annuaによる肝障害に関連する発表がいくつかあります(9、11-14)。 最近、中国中医薬学会から、薬草による肝障害の因果関係の評価と診断のための臨床ガイドラインが提案された(15)。 今回、エチオピアから帰国した患者において、化学予防としてアルテミシア茶を摂取したことにより急性胆汁性肝炎を発症した症例を報告する。
Case Report
51歳男性が、4日前から倦怠感、腹部違和感、浮遊性黄色便、黄疸および胆尿、過去6週間で6-8kg体重減少でスイスバーゼル大学病院救急部を受診した。 彼は診療を受ける3週間前に4週間のエチオピア旅行から帰国していた。 エチオピア滞在中、マラリアの化学予防薬として1.25 gのArtemisia annua粉末茶を日常的に摂取していた。 約90%は粉末を熱湯で薄め、残りの10%は食べ物に混ぜて摂取していた。 このサプリメントはインターネットで購入されたものでした。 患者から容器が提供され、その中にはもともと50gの濃い緑色の粉末が入っていた(図1)。 エチオピア滞在中、彼は他のお茶のようなものも摂取していた。 私たちの知る限り、これらの物質に関連した肝毒性は報告されていない。 彼は、他の処方薬、市販薬、漢方薬の摂取を否定した。 肝臓疾患、アルコール、薬物乱用、ウイルス性肝炎の危険因子の既往や家族歴はなかった。 彼は、エチオピアへの旅行に同行した妻もマラリア予防のためにArtemesia annua茶を摂取していたと報告した。

Figure 1. Artemisia annua powder tea.
著しい黄疸を除けば、全身状態は良好で、バイタルサインも異常なし(無熱で血圧、心拍、呼吸数は正常)。
臨床検査では、アラニンアミノトランスフェラーゼ(ALAT)91U/L(正常、9-59)、アスパラギン酸アミノトランスフェラーゼ(ASAT)42U/L(正常、9-34)、アルカリホスファターゼ(ALP)151U/L(正常、40-130)、γ-グルタミルトランスフェラーゼ(GGT)416U/L(正常、12-68)、総ビリルビン186.6 μmol/L(正常値,0-24)(抱合型ビリルビン168.5 μmol/L),国際標準化比率(INR)0.9(正常値,0.9-1.3)であった. 胆汁酸は460.5μmol/L(正常値、0-8.0)と高値を示した。 微分血球数,CRPは正常であった. 軽度の低ナトリウム血症と低クロル血症が認められ、前日までの水分摂取量の増加と一致した。 A,B,C,E型急性肝炎,Epstein-Barrウイルス,サイトメガロウイルス感染症の血清学的検査は陰性であった. Coeruloplasminは正常であった. 肝臓特異的自己抗体(抗核抗体,抗好中球抗体,抗平滑筋抗体,抗ミトコンドリア抗体,抗プロテアーゼ3抗体,抗ミエロペルオキシダーゼ抗体)は陰性で,IgA,IgM,IgGは正常範囲内であった. 腹部超音波検査では肝実質,血管,胆管は正常であった. 肝エラストグラフィーは上昇していた(FibroScan, 12.7 kPa, 正常範囲 <5 kPa)。
この患者は、スイス熱帯公衆衛生研究所で、潜在的な基礎感染症の様々な評価も受けた。
最初の肝生検では、胆管のリンパ球浸潤とびまん性の胆管内および細胞質内ビリルビノスタシスを伴う門脈性肝炎が認められた。 線維化や寄生虫は認められませんでした(図2A,B)。 末梢血白血球のDNAを用いた次世代シークエンス解析により,胆汁酸の恒常性維持に最も重要な3つの肝トランスポーター,すなわちBSEP,MDR3,FIC1をコードする遺伝子の変異を調べた結果,遺伝性胆汁酸疾患に典型的に関連する変異は認められなかった
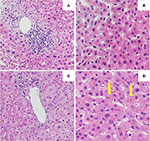
Figure 2. 1回目(A,B)、2回目(C,D)の肝生検の組織像。 (A) 門脈リンパ球浸潤を示す肝生検の低倍率像 。 (B) 細胞内ビリルビノスタシスを伴う肝実質(HE, 20倍)。 (C) 重大な門脈炎を認めない肝生検の低倍率像(HE, 10倍)。 (D)細胞内・細胞外(矢印)のビリルビノスタシスが顕著な肝実質(HE, 20x)。
液体クロマトグラフィー-質量分析およびガスクロマトグラフィー-質量分析によるヨモギ茶の毒性分析では、以下の成分が検出された:アルテアンインb、デオキシアルテミシン、カンファーおよびスコポルテン。
プレドニゾン20mg1日2回とウルソデオキシコール酸500mg1日2回の治療が開始されました。 治療にもかかわらず4週間にわたりビリルビンが増加し、黄疸が持続したため、2回目の肝生検が行われた。 2回目の生検では、細胞質内および管内ビリルビノスタシスが強く、1回目の生検と比較して炎症は軽微であった(図2C,D)。 副腎皮質ステロイドの投与は中止し、ウルソデオキシコール酸の投与を黄疸の消失とビリルビンの正常化(15.3μmol/l)(図3)まで継続し、発症から3ヵ月後に胆汁酸の減少(19.5μmol/l)がみられた(<9443> <7877><7877><6825><6791>Figure 3. ビリルビンと肝酵素の経時的経過
この症例は、スイスの治療製品に関する国家当局(Swissmedic)のファーマコビジランス部門に報告されました。
Discussion
アルテミシニン誘導体は、マラリアの化学予防ではなく、治療の基礎となるものである(2)。 その広範な使用にもかかわらず、アルテミシニン誘導体による肝障害はほとんど報告されていない(8、10)。 9443>
Herbal and dietary supplements -induced liver injuryは、HDSが世界中でますます使用されているため、関心が高まっているテーマである(7)。 HDSの摂取は無害とみなされることが多いが、その使用に伴って発生する有害事象の数が増加していることが報告されている(16)。 また、HDSの濃度や成分は製品ラベルに記載されていないことが多く、製品の品質や成分量が不明なままである。 我々の場合、曝露と副作用発現の間に強い時間的関係があり、他に考えられる病因がないことから、Artemisia annua teaの摂取によるHDS誘発性肝障害と診断された。 RUCAM(Roussel Uclaf Causality Assessment Method)(17)に従って因果関係評価スコアを算出し、原因薬剤の因果関係が「probable」に相当するスコア6を得た。 スコアは、発症までの時間(+2)、経過(+1)、危険因子(+1)、併用薬(-1)、他の肝障害原因の除外(+2)、薬剤の肝毒性に関する過去の情報(+1)、再投与への反応(0)の各項目で評価された。 9443><6791>Kumarが以前に報告した症例は、肝細胞性肝障害のパターンを示し、その後、長期の胆汁うっ滞期が続いた(10)。 本症例は、Artemisia annua teaの初回摂取から5週間後に、主に胆汁うっ滞性の肝障害を呈している。 自然経過はKumarのケースと同様であるが、肝障害の進行の遅い段階で発症したと推測される。 摂取したハーブティーの毒物学的分析では、Artemisia annuaに自然に存在するscopoletinとcamphorを追加で特定し(18、19)、胆汁性肝障害の発症に寄与した可能性がある。 アルテミシアエの化学成分には、揮発性油、フラボノイド、タンニン、トリテルペン、多糖類などがある。 Artemisiae spp の揮発性オイルは強い薬理活性と毒性を持ち、最近のバイオインフォマティクスアプローチにより、肝障害の発生に関与すると思われる様々な経路が同定された(20)。 薬剤による胆汁性肝障害の素因は、胆汁酸塩輸出ポンプ多型と関連している(21, 22)。 そこで、次世代シークエンスにより胆汁酸トランスポーターの変異体を検索した。 その結果、BSEP、FIC1、MDR3をそれぞれコードするABCB11、ATP8B1、ABCB4遺伝子配列(コード領域およびフランキング領域)に欠失、重複、病理的変異は検出されなかった(図4)。 しかし、多くの共通配列変異が確認された。 我々の患者は、ABCB11遺伝子の変異体をホモ接合的に保有していた。 この多型が良性再発性・進行性の身近な肝内胆汁うっ滞や妊娠性肝内胆汁うっ滞と関連するかどうかは議論されている(23, 24)。 さらに、ABCB11遺伝子のもう一つの一般的な変異がヘテロ接合状態で検出された。 この変異体は、蛋白発現の低下(25)や原発性胆汁性肝硬変(26, 27)と関連しているとされている。 しかし、この2つの遺伝子変異は、胆汁性肝疾患の原因となるには、一般集団での頻度が高すぎる(28)。 このような症例におけるトランスクリプトームの系統的な配列決定により、遺伝子配列の他の領域や、ABCC2、ABCC3、ABCC4、タイトジャンクションプロテイン2(TJP2)などの胆汁生成に関わる他の肝臓トランスポーターまたはタンパク質をコードする他の遺伝子にそれぞれ変異があることが判明するかもしれない(21)
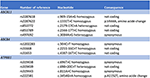
FigURE 4. ABCB11、ABCB4、ATP8B1遺伝子の分子遺伝学的解析。
以上、Artemisia annua茶の摂取に適合した重症HDSによる胆汁酸肝障害の一例を報告した。 マラリア予防のためのアルテミシニン誘導体の使用は、WHOの勧告では効果がなく、さらに害をもたらす可能性があるため、使用を控えるよう努力すべきである。
Data Availability Statement
この研究のすべてのデータセットは、原稿/補足ファイルに含まれています。
Ethics Statement
この臨床例の報告は、地域の法律と施設の要件に基づき、倫理的審査と承認を必要としませんでした。
Author Contributions
FR-R が初稿を執筆した。 また、菅原稔彦、菅原稔彦、菅原稔彦、菅原稔彦、菅原稔彦、菅原稔彦は原稿の一部を執筆した。
Conflict of Interest
The authors are declared that the research was conducted in any commercial or financial relationships that could be construed as a potential conflict of interest.
1.Klayman DL.MH.LT.CB.CB.CB. Qinghaosu (artemisinin): an antimalarial drug from China. サイエンス。 (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2.このような場合、あなたはどのようにすればよいですか? 世界保健機関. マラリア治療のためのWHOガイドライン、第2版。 (2010). オンラインで入手可能。 http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (accessed November 23, 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). でオンライン公開されています。 http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (accessed November 23, 2018).
Google Scholar
4.安全な旅行. 米国疾病管理予防センター。 マラリア予防のための薬剤の選択(2018年). でオンラインで入手可能。 https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. アフリカから帰国した旅行者におけるアルテスネートの誤用とマラリア原虫。 エマージェンシーインフェクトディス。 (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. 世界保健機関. WHO、ポジションステートメント。 マラリアに対するArtemisia annua L.の非薬品形態の有効性。 ジュネーブ。 世界保健機関(2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. ハーブや栄養補助食品による肝障害。 ヘパトロジー(Hepatology)。 (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8.ハーブのサプリメントによる肝障害。 Guevart E, Aguemon A. Artesunate-amodiaquine combinationによる治癒的治療中に劇症肝炎を発症した2症例. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9.邦訳:「劇症肝炎」。 疾病管理予防センター(CDC)。 アルテミシニンを含むハーブのサプリメントに一時的に関連した肝炎-ワシントン州、2008年。 Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Cholestatic liver injury secondary to artemisinin. Hepatology. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11.アルテミシニンに続発する胆汁性肝障害。 Stebbings S, Beattie E, McNamara D, Hunt S. A pilot randomized, placebo-controlled clinical trial to investigate the efficacy and safety of anua extract administered over 12 weeks, for managing pain, stiffness, and functional limitation associated with the osteoarthritis of the hip and knee. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12.日本学術振興会特別研究員(DCA)。 メドセーフ Arthrem – Potential Risk of Harm to the Liver -Statement Under Section 98 of the Medicines Act 1981 (2018). にてオンライン公開。 http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13.メドセーフ.アーストレム.アーストレム.アーストレム.アーストレム. 米国国立衛生研究所、LiverTox、薬剤誘発性肝障害に関する臨床・研究情報。 アルテミシニン誘導体。 (2019). でオンライン公開されている。 https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicity with a Natural Dietary Supplement, Artemisia annua L. Extract in Grapeseed Oil.(グレープシードオイル中の天然栄養補助食品、アルテミシア・アヌアL.エキスの肝毒性). ニュージーランド・ファーマコビジランス・センター・レポート。 Drug Safety (2018). In: 第18回ISoP年次総会 “Pharmacovigilance without borders”. Geneva (accessed November 11-14, 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. ハーブによる肝障害の診断と管理に関するガイドライン. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16.ハーブによる肝障害の診断と管理ガイドライン(PubMed). Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. 成人における補完的な健康アプローチの使用傾向。 米国、2002-2012年。 Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17.クラークTC、ブラックLI、スタスマンBJ、バーンズPM、ナヒンRL.成人の補完的健康アプローチの使用動向:米国、2002年から2012年。 Danan G, Teschke R. RUCAM in drug and herb induced liver injury: the update. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18.ダナンG, テシュケR. また、このような環境下において、「環境保全型社会」を実現するためには、「環境負荷低減型社会」の実現が不可欠である。 PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variations in antimalarial components of Artemisia annua Linn from three regions of Uganda.(ウガンダの3つの地域から採取したヨモギの抗マラリア成分のバリエーション). Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20.邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:邦訳:「邦訳」。 劉 浩、詹 聡、張 毅、馬 毅、陳 麗華、他 分子ネットワークによるArtemisiae argyi foliumの揮発性油による肝障害のメカニズムの解析。 BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21.邦訳:「肝障害の分子ネットワーク解析」。 Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. 胆汁酸塩輸出ポンプ機能の阻害は、医薬品開発におけるヒト肝障害の感受性因子である。 Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease(健康と病気における胆汁酸輸出ポンプ). 臨床研究Hepatol Gastroenterol。 (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23.胆汁酸輸送ポンプ(BSEP):健康と疾患における胆汁酸輸送ポンプ。 Alissa FT, Jaffe R, Shneider BL. 進行性家族性肝内胆汁うっ滞症に関する最新情報。 J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24.進行性家族性肝内胆汁うっ滞症の最新情報。 Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy(妊娠性肝内胆汁うっ滞の分子遺伝学). Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25.妊娠中の胆汁うっ滞の分子遺伝学的研究。 Stieger B. Na-taurocholate cotransporting polypeptide (NTCP) と bile salt export pump (BSEP) の胆汁生成の生理・病態における役割。 Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26.胆汁酸塩の生成における胆汁酸塩輸送ポリペプチド(NTCP)と胆汁酸塩輸出ポンプ(BSEP)の生理と病態。 Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. BSEPとMDR3ハプロタイプ構造(健常白人、原発性胆汁性肝硬変、原発性硬化性胆管炎において). Hepatology. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. ABCB4およびABCB11遺伝子の変異は原発性肝内結石と関連している。 Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28.李 X. (2015) 11:434-46. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. 胆嚢症患者の大規模コホートにおけるFIC1、BSEP、MDR3の配列決定により、多数の異なる遺伝子バリアントがあることが明らかになった。 J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar