1. 透過性
2.流動性
3.不均一性
-内側
-外側
-曲り、厚み
細胞膜機能はその分子組成により決定されます。 これらの分子の種類と割合によって、半透性、非対称性、流動性、修復性、リサイクル性といった膜の物理化学的特徴が設定される。
Permeability
膜の半透性は、脂質の脂肪酸鎖によって作られた膜の内部の疎水性環境の結果で、電荷を持つ分子が横断しにくくなっている。 このため、膜は分子の自由な拡散を防ぐことで、内部と外部の環境を区別したコンパートメントを形成することができる。 ただし、透過性は選択的である。 膜を通過する能力を左右する分子の特徴として、極性と大きさがより重要である。 電荷を持たないCO2、N2、O2などの小分子や、エタノールなどの脂溶性の分子は、受動拡散によってほとんど自由に膜を通過することができる(図1)。 水やグリセロールのような電荷をもたない分子(無電荷分子)は、正の電荷の数と負の電荷の数が等しくなると透過性が低くなる。 水は自由に膜を通過できると思われがちだが、いくつかの制限がある。そのため、膜にはアクアポリンという膜貫通タンパク質の一種があり、水を自由に通過させるチャネルが存在するのである。 ブドウ糖のような電荷を持たない大きな分子は、膜を通過する能力が低い。 膜はイオンや電荷を帯びた分子に対して高い不透過性を示す。 受動拡散による透過係数の値をいくつか挙げる。 O2:2.3cm/s、CO2:2.5cm/s。 0.35 cm/s、H2O: 0.0034 cm/s、グリセロール: 10 -6 cm/s、ナトリウムとカリウム: 10 -14 cm/s。
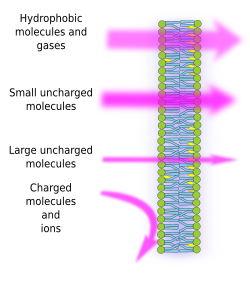
イオンと分子が膜の両側で不均等に分布することで、電気化学的勾配を生成し維持することが可能になる。 電荷の内側と外側の濃度の差は、膜電位として知られている。 この電位差は、ATP合成や神経伝達など、多くの細胞機能に利用されている。 半透膜はまた、浸透圧過程にも関与している。浸透圧とは、膜を越えて、一方の濃度の低い溶液から他方の濃度の高い溶液へと、両方の濃度を等しくするための水の移動のことである。 このように、植物細胞は、細胞内の溶質濃度が高くなることで細胞内に水が入り込み、細胞壁を外側に押し出す静水圧(ターゴル圧と呼ばれる)が発生し、細胞を大きくすることができるのである。 膜を自由に通過できない分子は、勾配を作ることができるため、細胞にとって有用であり、情報機構として、あるいはエネルギー貯蔵として働くことができる。 細胞には、膜を通過することができる膜貫通タンパク質があり、内膜の疎水性環境を避けて、細胞膜の両側で荷電分子やイオンを移動させることができます。 例えば、筋肉の収縮は、既存のイオン勾配を減少させるチャネルの開口によって引き起こされる。
半透性は、膜の脂質組成に影響される。 例えば、細胞膜ではコレステロールの含有量が重要である。 コレステロール含量が増加すると、膜の流動性が低下し、疎水性が増加し、膜が不透過性になる。 このため、ミエリン膜は、30%以上のコレステロールを含むと、軸索を絶縁し、軸索に沿った活動電位の伝搬を最適化するのに非常に適している。
流動性とラテラルドメイン
流動性は膜の特性のひとつである。 膜の内部で分子が移動する能力に関係する。 流動性が高いということは、動きがより頻繁であることを意味する。 細胞膜は実は脂肪のシートで、分子は半液体の粘性状態になっている。 したがって、分子は拡散によって移動することができると推測できる。 例えば、細胞膜の外側の単層にあるグリセロリン脂質は、同じ単層で横方向に動く場合と、単層から別の単層に飛び移るフリップフロップ型の2種類の動きをすることがある(図2)。 人工膜では、この2種類の動きが観察されており、横方向の動きがフリップフロップよりも頻繁に起こっている。 横方向への拡散では、脂質は20秒で30μm、中型の細胞では1分で全周を移動することができる。 しかし、フリップフロップ運動は、親水性の頭部が脂肪酸鎖の内層を横切る必要があり、熱力学的に困難であるため、実際にはあまり行われない。 1つの脂質分子に対して、フリップフロップ移動が起こる確率は1ヵ月に1回程度です。 しかし、コレステロールは挙動が異なり、非常に簡単にフリップフロップをすることができます。

膜の流動性は、化学組成によって変化することがある。 一般に、脂肪酸鎖が短く、脂肪酸の炭素間の不飽和結合の量が多いほど、膜の流動性が高くなる。 また、コレステロールの量も膜の流動性に影響を与えるが、その効果は温度や膜中の脂質の種類に依存する。 コレステロールは、固体ゲル状態への移行を抑制する(流動性が低下する)だけでなく、不飽和脂肪酸鎖の柔軟性を低下させるという2つの効果を持つ。 一般に、コレステロール濃度の上昇は膜の流動性を低下させると言えますが、低温では逆の効果があります。 小胞体の膜のような細胞内部の膜は、コレステロールをほとんど含まないため、より流動性が高い。 さらに、コレステロールは膜に疎水性という別の性質を与え、膜をより不透過性にする。
膜の非対称性として知られる2つの単層間の異なる分子組成は、それぞれの単層で異なる流動性を発生させる可能性があります。 分子組成に応じて、脂質は、液体秩序化(流動性が低い)および液体無秩序化(流動性が高い)の2つの物理相になることがある。 細胞膜の外側の単層は秩序相にあることが多く、内側の単層は無秩序相にあることが多いとされている。
細胞はその化学組成を変化させることによって、膜の流動性を修正することができる。 例えば、細菌は、膜の流動性が環境条件に適応できるように、脂肪酸鎖の飽和度と長さを調整する。 また、ホスファチジルエタノールアミンなどのグリセロリン脂質の濃度も流動性を調節することができる。 昆虫の中には、コレステロールのようなステロールを合成できず、膜のステロールは食物から摂取しているものがある。 彼らは、ホスファチジルエタノールアミンの濃度を変えることで、細胞膜の流動性を変化させている。
ミトコンドリアの内膜は、プロトン勾配を作り出し維持するために、強い不透過性のバリアが必要である。 それはコレステロールの含有量を増やすことで可能になる。 この方法では疎水性は高くなるが、逆にコレステロールは流動性を低下させ、この膜のタンパク質の機能にとって非常に重要であると思われる。 ミトコンドリアは、不飽和リン脂質であるカルジオリピンでこの問題を解決し、疎水性を高めながらも、膜の流動性をあまり低下させないようにしているのである。
3.不均一性
膜の流動性のために、タンパク質はランダムに分布し、したがって膜は分子組成に関して均一である、すなわち膜領域によらず同じ分子量と割合を示すと考えることができる。 しかし、これは真実ではない。 分子の横方向への拡散に制限があるため、膜の不均一性が生じ、分子組成が異なる膜の領域が存在することになる。 偏光していない細胞や200nm以上のスケールでは、細胞膜は均質に見えるが、200nm以下のスケールでは不均質である。 膜のミクロドメインは60μm程度の大きさであると考えられている。 脂質やタンパク質は、数ミリ秒の間に60-200 nmの領域に限定された横方向の動きを見せ、その後、別の隣接する領域にジャンプし、そこでまた短時間留まる。 細胞骨格や細胞外マトリックスとの相互作用、膜分子同士の相互作用、膜局所領域の密度の違い(流動性の変化)、電荷量、膜の湾曲、膜ドメインの厚さの違いなどである(図3)<9029><5057><6020><8605>図3.分子横移動への制限 横方向の動きを制限し、マイクロドメインを生成する分子間相互作用を示す細胞膜のモデル。
内部相互作用
膜分子間の相互作用は横方向の動きを制限する。 タンパク質と脂質の動きは、これらの相互作用の影響を受け、分子組成の異なるマイクロドメインが形成される(図4)。 その結果、膜内の分子の横方向への不均質な分布が形成される。 脂質マイクロドメインは、分子の割合によって、固体、液体秩序、液体無秩序という異なる密度(=流動性)を持つことがある。 最も一般的な密度は液体無秩序であり、これは最も流動的である。
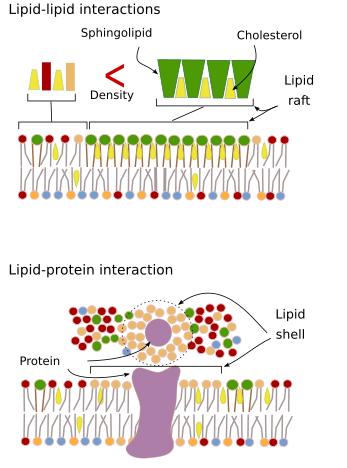
スフィンゴ脂質とコレステロールは、互いに自発的に結合し、運動性を低下させ、隣接する領域と比較して分子密度を増加させることがある。 脂質の海に浮かぶ筏のような小さな分子集団が形成されるのである。 実際、このような分子会合は「脂質ラフト」と呼ばれ、細胞膜に非常に多く存在すると考えられている。 脂質ラフトは非常にダイナミックな挙動を示し、移動、成長、縮小、出現、消滅を繰り返す。 実際、膜はグリセロリン脂質の間を横方向に移動する多数の高密度ドメインから構成されており、膜の分子分布は極めて不均質である。 ある種のタンパク質は、脂質ラフト内でより快適に過ごすことができるとする実験結果もある。 これらのタンパク質は、脂質ラフトの外側よりも内側でより多くの時間を過ごすため、これらの密度の内側をしばらく移動する。 これにより、膜に沿った分子の分離が起こり、異なる分子同士がより長い時間近づく確率が高くなり(拡散)、特定の分子反応が起こる確率が高くなるのです。 さらに、脂質ラフト中のある種の脂質が高濃度に存在することで、ある種の化学反応や分子間相互作用が起こりやすい独特の化学環境を作り出していることが示唆されている。 脂質ラフトは、スフィンゴ糖脂質が豊富に存在する外側の単層膜に存在することが提唱されている。 膜ドメインはオルガネラの膜にも存在することが示唆されており、オルガネラの機能の一部はこの膜ドメインに依存していると考えられている。
細胞膜の内側の単層では、タンパク質の塩基性ドメインや2価カチオンドメインと脂質の陰性極頭部が静電的相互作用によりマイクロドメインを形成している。 また、あまり知られていないが、ホスファチジルイノシトールビスリン酸とコレステロールが結合して、この単層膜にミクロドメインを形成している例もある。 細胞質に面したこれらのミクロドメインは、細胞内タンパク質の足場に影響を与える可能性がある。
従来、両単層膜の間には相互作用はなく、それぞれ独立してマイクロドメインが分布していると考えられてきました。 しかし、互いの間に相互作用があることを示唆する証拠もある。 膜貫通型タンパク質は膜全体を通過するため、両方の単層膜に同時に影響を与える。 また、スフィンゴ脂質のように炭素数24(通常18)の長い脂肪酸鎖が、両単層膜の同調を仲介している可能性もある。 これらの長鎖は、他方の単層膜の脂質の脂肪酸鎖の間に挿入され、脂質の分布に影響を与えている可能性がある。 さらに、長い脂肪酸鎖を持つ脂質ドメインは、もう一方の単層にある短い脂肪酸鎖の脂質マイクロドメインによって相殺され、膜の厚さを一定に保っていると考えられる。
膜タンパク質は、内在性と結合性の両方が、互いに作用し、情報の伝達、細胞-細胞の認識、いくつかの酵素活動の開始、細胞の移動を促進するために高分子足場に組み上がることもある。 また、すべてのサブユニットが一緒になって初めて活性を発揮する多量体タンパク質も存在する。 例えば、インスリン受容体は4つのサブユニットで構成されている。 また、タンパク質と脂質が相互作用して膜ドメインを形成することもある。 例えば、内側の単層膜では、ホスファチジルイノシトールが電気的相互作用によってタンパク質の周りに結合しているが、これは脂質の極性頭部のリン酸塩を調節することによって制御することが可能である。
外層との相互作用
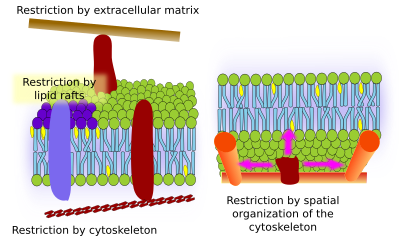
膜内部タンパク質も横方向の動きを持つことがあるが、脂質よりも制限され、そのほとんどはそれぞれ細胞外ドメインおよび細胞内ドメインを介した細胞外マトリックスおよび細胞骨格との相互作用による(図5)。 これらの相互作用により、タンパク質は拡散だけでなく、より長い時間、膜の小さな領域にとどまっている可能性がある。 細胞骨格は、細胞膜の直下に柵を形成し、タンパク質を狭い領域に制限している可能性がある。 アクチンフィラメントや微小管は小さな領域を囲み、タンパク質や脂質の拡散を制約することがある。 細胞骨格が実験的に乱れると、膜はより均質になるため、細胞骨格との相互作用は重要である。 細胞には、タンパク質を特定の領域に閉じ込めるメカニズムが他にもある。 例えば、腸管上皮細胞では、一部のトランスポーターや酵素は頂膜に存在するが、底側ドメインには存在しない。これは、頂膜と底側ドメインの間の拡散を防ぐタイトジャンクションという分子ジッパーのベルトが存在するためである。 このような非対称的な分布は、上皮細胞の生理機能にとって不可欠である。
膜の曲げ加工もマイクロドメインを作る方法の一つである。 膜の湾曲は、小胞、細胞拡張のための細胞質延長、オルガネラの形状変化または成長、あるいは単に分子の横方向の動きを制限するための障壁を形成するための出発点となる場合がある。 これは、膜の折り畳み角度が小さくなるように脂質が3次元的に配置されることによる物理的な制限である。
膜を曲げるために必要な分子ツールは、膜の特定の領域に採用される。 これらのミクロドメインは、特定の脂質組成や特定の電荷環境を持っているかもしれない。 ホスホイノシチド(PIP)、主にPIP2とPIP3は、膜を曲げるためのタンパク質のリクルートに貢献する脂質である。 PIPは、極性頭部の電荷や分子構造を化学反応によって容易に変化させることができるため、有用な分子とされている。 このように、特定の膜領域の性質を必要な時に変化させ、特定のタンパク質をリクルートすることができる。 ホスファチジルセリンもまた、フリップアゼによって一方の単層から他方の単層に移動する際に、膜を曲げるためのマイクロドメインを開始することができる。
Bending and thicknes
脂質のマイクロドメインは、膜を効果的に曲げるタンパク質を勧誘する。 この役割に特化したタンパク質が存在する(図6)。 BARドメインタンパク質(Bin/amphyphysin/Rsv161)はその一つである。 曲げは、膜を引っ張ったり押したりするタンパク質が曲がった足場を組み立てることと、脂質の間にアミノ酸配列をくさびとして挿入することの2つのメカニズムによって誘導されると考えられる。 例えば、カベオリンは膜の湾曲を引き起こしカベロアを形成し、テトラスパインは膜を強制してチューブを形成し、ESCRTはエンドソーム内の小胞形成を助けてマルチビキュラーボディを形成している。 アクチンは、アクチンフィラメントの重合によって膜を強く曲げ、細胞膜を外側に押し出し、細胞の膨張につながる。 また、細胞膜を湾曲させる多くのタンパク質がアクチンの重合を活性化している
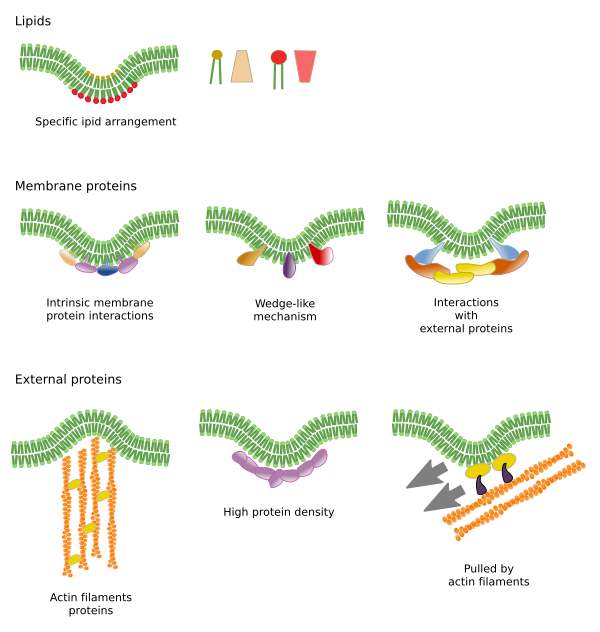
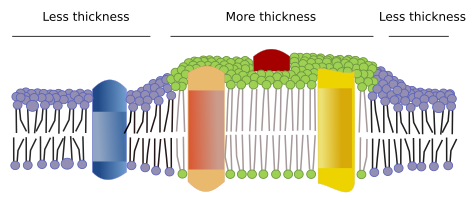
膜には他にも、膜貫通タンパク質などの分子によって形成される物理的なドメインが存在する。 これらの領域は、より長い脂肪酸鎖を持つ脂質に囲まれた、より長い疎水性アミノ酸配列を持つタンパク質を含むので、異なる膜厚を示す(図7)。 これらのタンパク質と脂質は、一緒にいると疎水性の部分がきちんとフィットするので、「気持ちいい」のです。 これらのタンパク質と脂質は、疎水性領域が短い他の分子(タンパク質でも脂質でも)を排除する膜ドメインを形成している。
Bibliografía
Honigmann A, Pralle A. (2016). 細胞膜のコンパートメント化. ジャーナル・オブ・モレキュラー・バイオロジー 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). 細胞生物学における膜の湾曲:分子機構の統合. ジャーナル・オブ・セルバイオロジー。 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017).を参照。 High cholesterol/low cholesterol: effects in biologicalmembranes: a review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.