Introduzione
Secondo l’Organizzazione Mondiale della Sanità, la depressione colpisce circa 350 milioni di persone nel mondo (Organizzazione, 2017). I pazienti con depressione indicano sintomi di disturbi d’ansia e accompagnati da incapacità di provare piacere e interesse, perdita di concentrazione, dubbi su se stessi, ansia sociale, disturbi del sonno e dell’appetito (Namola et al., 2015). I principali fattori che causano la depressione sono squilibri chimici o ormonali nel cervello. Il principale ormone associato alla depressione è la serotonina. Altri ormoni sono la norepinefrina e la dopamina (Yi et al., 2008). Questi ormoni sono necessari per il normale funzionamento del cervello e per controllare i sentimenti. La distruzione di questi ormoni può causare uno squilibrio chimico nel cervello con conseguente depressione.
La depressione può essere trattata a seconda della sua gravità, tramite psicoterapia o farmaci. Gli antidepressivi sono i principali tipi di farmaci usati per trattare la depressione. Ci sono molti tipi diversi di farmaci antidepressivi disponibili, e differiscono solo nel modo in cui agiscono sul cervello, il loro costo, e il loro profilo di effetti collaterali. Nel trattamento di prima linea, alla maggior parte dei pazienti viene prescritto un antidepressivo triciclico (TCA) o un inibitore selettivo della ricaptazione della serotonina (SSRI; McCarthy et al., 2016). I farmaci comunemente usati per il trattamento dell’ansia sono le benzodiazepine. Anche se ci sono molti farmaci antidepressivi sul mercato utilizzati per trattare la depressione, i postumi dell’uso di questi farmaci sono di grande preoccupazione (Binfaré et al., 2009). Una terapia alternativa della depressione è l’uso di farmaci a base di erbe (Fajemiroye et al., 2016). L’uso di estratti di erbe sta guadagnando una più ampia accettazione da parte della professione medica e dei pazienti. La maggior parte dei rimedi erboristici utilizzati per il trattamento della depressione sono estratti grezzi o semipurificati (Calixto et al., 2000; Carlini, 2003; Guan e Liu, 2016).
C’è scarsità nei rapporti sulle ricerche che riguardano il principio attivo in grado di indurre attività sul sistema nervoso centrale (SNC). Una revisione di Carlini (2003) include informazioni solo sugli effetti psicoanalettici, psicolettici e psicodislettici. Una recente revisione di Guan e Liu (2016) ha discusso la relazione struttura-attività degli effetti antidepressivi dei flavonoidi isolati da fonti naturali e sintetiche. Gli alcaloidi indolici sintetici, la loro attività e il loro potenziale uso in medicina sono già stati rivisti in diversi articoli (de Sa et al., 2009). Tuttavia, non è stato pubblicato alcun articolo di revisione che correli gli alcaloidi indolici vegetali isolati con l’attività antidepressiva. Questa revisione fornisce informazioni sul potenziale degli alcaloidi indolici naturali per il trattamento dei disturbi neurologici, sugli studi di relazione struttura-attività e sull’estensione di questi ad altri metaboliti bioattivi come potenziali farmaci antidepressivi dalla prospettiva della struttura chimica. È compilato attraverso l’indagine bibliografica di riviste scientifiche e la letteratura pertinente identificata attraverso Web of Science database elettronici.
Piante antidepressive
Questo articolo di revisione si occupa di piante che possiedono attività sul SNC. Anche se molti tipi di piante rientrano in questa categoria, evidenzieremo solo le piante che mostrano proprietà antidepressive. Due piante che contengono alcaloidi indolici sono Passiflora incarnata L. (passiflora) e Mitragyna speciosa (Korth.) Havil (kratom), mentre le altre due piante che non hanno mostrato la presenza di alcaloidi indolici sono Piper methysticum G. Forst (kava) e Valeriana officinalis L., meritano particolare attenzione. La struttura chimica dei composti isolati da queste piante può essere usata come base per lo sviluppo di nuovi farmaci.
Passiflora incarnata e altre specie come P. alata Curtis, P. coerulea L. e P. edulis Sims sono ampiamente usati come sedativi nella medicina tradizionale nella maggior parte dei paesi europei e in America (Houghton e Seth, 2003). La struttura dei farmaci benzodiazepinici consiste in un anello benzenico fuso ad un sistema diazepinico che comprende una moiety eterociclica a sette membri con due atomi di azoto nelle posizioni 1 e 2 dell’anello. Gli alcaloidi indolici isolati da P. incarnata e cioè harman, harmol, harmine, harmalol e harmaline consistono in un anello benzenico fuso a un eterociclo di cinque membri contenente un atomo di azoto.
Diversi studi hanno indicato che P. incarnata ha un profilo farmacologico simile alle benzodiazepine e agisce attraverso i recettori dell’acido gamma-aminobutirrico (GABA) (Jawna-Zboiñska et al., 2016). Le foglie di M. speciosa sono state usate come medicina tradizionale per trattare la diarrea, il diabete e per migliorare la circolazione del sangue (Vicknasingam et al., 2010). La mitraginina è il principale alcaloide indolico presente nella M. speciosa con i suoi analoghi, specioginina, paynantheine e speciociliatine (León et al., 2009). Due studi condotti sull’estratto acquoso e sull’estratto alcaloidale di M. speciosa hanno indotto un effetto antidepressivo su modelli murini di disperazione comportamentale (Kumarnsit et al., 2007). Uno studio condotto da Idayu et al. (2011) sulla mitraginina mostra l’effetto degli antidepressivi in modelli comportamentali animali di depressione attraverso l’interazione con l’asse ipotalamo-ipofisi-surrene (HPA) nel sistema neuroendocrino (Idayu et al., 2011).
Piper methysticum G. Forst viene consumato come una bevanda chiamata kava che induce uno stato mentale piacevole verso la sensazione di allegria mentre riduce la fatica e l’ansia (Bilia et al., 2002). Lo studio mostra che la maggior parte delle attività farmacologiche sono conservate dall’estratto lipido-solubile rispetto all’estratto acquoso. L’estratto lipido-solubile contiene almeno sette pironi, noti come kavalattoni. I kavalattoni interagiscono generalmente con le neurotrasmissioni dopaminergiche, serotonina, acido gamma aminobutirrico (GABA), glutamatergiche, previene la monoammina ossidasi B (MOB) e fornisce anche una varietà di effetti sui canali ionici (Grunze et al., 2001). La diidrometisticina è uno dei sei principali kavalattoni presenti nella pianta di kava. La struttura della diidrometisticina comprende un arilene-α-pirone legato a una proprietà simile all’indolo che comprende due ossigeni invece di nitrogeni. Contribuisce all’attività ansiolitica e agisce come farmaco antidepressivo. Studi in doppio cieco controllati con placebo hanno dimostrato che i kavalattoni svolgono attività ansiolitiche senza deprimere le funzioni mentali e motorie e migliorano la qualità del sonno. I kavalattoni sono un’alternativa per sostituire l’uso delle benzodiazepine nella terapia della depressione (Malsch e Kieser, 2001).
Valeriana officinalis L., conosciuta anche come valeriana è ampiamente utilizzata da molti paesi come sedativo, anticonvulsivo, per gli effetti ipnotici e l’attività ansiolitica (Ghaderi e Jafari, 2014). L’acido valerenico e i valepotriati sono stati segnalati come principi attivi in preparati farmaceutici e gli estratti grezzi commerciali di valeriana hanno registrato un uso in molti paesi (Bos et al., 2002). I valepotriati che comprendono i triesteri di poliidrossiciclopenta-(c)-pirani con gli acidi carbossilici: acetico, valerico, isovalerico, α-isovaleroxy-isovalerico, β-metilvalerico, β-acetoxy-isovalerico, β-idrossiisovalerico e β-acetoxy-β-metilvalerico, sono usati come sedativi. I valpotriati sono instabili, termolabili e si decompongono rapidamente in condizioni acide o alcaline in acqua, così come in soluzioni alcoliche (Bos et al., 2002). I Valepotriati sono utili per migliorare le condizioni degli animali e dell’uomo durante le crisi di astinenza da benzodiazepine (Poyares et al., 2002).
Anche se ci sono una varietà di costituenti chimici diversi, il meccanismo d’azione è riportato come interazione della valeriana con il sistema GABA nel cervello attraverso l’inibizione della transaminasi GABA, l’interazione con il recettore GABA/benzodiazepina e l’interferenza nell’assorbimento e nel reclutamento del GABA nei sinaptosomi (Sichardt et al., 2007). Vari modelli sono stati utilizzati per studiare gli effetti antidepressivi delle piante. Modelli farmacodinamici includono modelli in vitro, in vivo e clinici sono stati utilizzati per valutare gli effetti (Tabella 1). La maggior parte delle specie di piante selezionate esaminate sono state studiate a livello in vivo, pochi studi in vitro e solo la kava è stata sottoposta a studi clinici. In tutti i casi, è necessario effettuare ulteriori ricerche per stabilire i composti attivi, la dose più efficace e per determinare se questa varia tra i diversi tipi di depressioni.

TABELLA 1. Informazioni sugli studi di farmacologia delle piante recensite.
Alcaloidi indolici
Gli alcaloidi indolici hanno una struttura biciclica, costituita da un anello benzenico a sei membri fuso con un anello pirrolico a cinque membri contenente azoto. Questo anello pirrolo con atomo di azoto dà origine alle proprietà fondamentali degli alcaloidi indolici che li rendono particolarmente attivi dal punto di vista farmacologico (El-Sayed e Verpoorte, 2007). Gli alcaloidi indolici sono ampiamente distribuiti nelle piante appartenenti alle famiglie delle Apocynaceae, Loganiaceae, Rubiaceae e Nyssaceae. Importanti alcaloidi indolici che sono stati isolati dalle piante includono il farmaco antipertensivo, la reserpina dalla Rauvolfia serpentina (Sagi et al., 2016) e i potenti farmaci antitumorali, vinblastina e vincristina da Catharanthus roseus (El-Sayed e Verpoorte, 2007). Gli studi sull’efficacia degli alcaloidi indolici nel trattamento della depressione non è nuova ed è stata condotta fin dal 1952, ma attualmente la comunità scientifica ha prestato pochissima attenzione ai benefici dell’utilità terapeutica delle piante dotate di proprietà antidepressive.
Gli alcaloidi indolici sono spesso associati alla funzione dei recettori delle proteine G, in particolare per la trasmissione del segnale neuronale attraverso i recettori della serotonina (5-HT/idrossitriptamina). Oltre al donatore di idrogeno tramite N-H libero, la presenza di densità di elettroni π contribuisce all’energia dell’orbitale molecolare più occupato (HOMO) dello scheletro planare dell’indolo. Questo permette l’interazione con le nucleobasi, in particolare con l’atomo protonato e con le proteine bersaglio (de Sa et al., 2009). La struttura chimica del neurotrasmettitore serotonina è basata su un anello indolico aromatico ricco di elettroni. La presenza dell’atomo di azoto nell’anello indolico serve a mantenere il sistema aromatico e rende il legame N-H acido piuttosto che l’azoto basico. L’anello indolico è in grado di formare legami a idrogeno attraverso la parte N-H e interazioni π-π stacking o catione-π, attraverso la parte aromatica (Shimazaki et al., 2009). L’idrofobicità degli anelli indolici è quasi la stessa della subunità fenilica e meno idrofobica dei classici anelli isosterici benzotiofene e benzofurano. Il gruppo indolico N-H gioca un ruolo decisivo nell’interazione con il biorecettore bersaglio, mentre i derivati sintetizzati del benzotifene e del benzofurano mostrano un’affinità moderata o limitata per il biorecettore bersaglio (de Sa et al., 2009). La reserpina è uno degli esempi di alcaloidi indolici isolati negli ultimi 60 anni che mostrano un’azione sedativa sul SNC. Tra l’altro, due sostanze chimiche, cioè la triptamina e la serotonina che si trovano nel cervello sono anche derivati degli alcaloidi indolici.
Attualmente i costituenti attivi degli estratti di piante responsabili dell’effetto antidepressivo non sono ancora chiari. Così cerchiamo di identificare alcune importanti strutture chimiche isolate da estratti di piante che mostrano attività antidepressive e accertare la somiglianza del modello di scheletro che potrebbe contribuire all’attività antidepressiva. I primi tentativi sono stati fatti per identificare le somiglianze strutturali tra la serotonina e gli alcaloidi indolici. La somiglianza più evidente consiste in anelli eterociclici a sei membri fusi ad anelli a cinque membri. La differenza è la presenza di un atomo di azoto o la distribuzione degli elettroni π (Figura 1). Attraverso uno studio di relazione struttura-attività Nichols (2012) ha riportato che la variazione di attività dei diversi tipi di molecole suggerisce che il recettore è molto sensibile alla natura della triptamina. Altri composti chimici che sono stati isolati con successo da piante antidepressive sono menzionati in questo documento di revisione perché sono forse agonisti specifici con particolari modelli di sostituzione che in grado di attivare selettivamente un sottoinsieme di effettori. Questo fenomeno è ora noto come selettività funzionale.
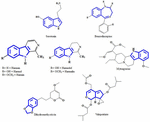
FIGURA 1. Strutture chimiche di serotonina, benzodiazepina e composti isolati da piante antidepressive. Somiglianza nello schema dello scheletro, che consiste di anelli eterociclici a sei membri, attaccati con anelli a cinque membri.
La serotonina, è ampiamente utilizzata nelle funzioni cerebrali e nella cognizione come agonista del recettore endogeno (Fink e Göthert, 2007). La serotonina esercita le sue funzioni attraverso sette famiglie di recettori (5-HT1-5-HT7) che sono membri della famiglia dei recettori accoppiati alle proteine G. Un certo numero di composti con la parte indolica sono stati descritti per avere affinità verso diversi recettori della serotonina (Kochanowska-Karamyan e Hamann, 2010). La somiglianza strutturale degli alcaloidi indolici (agonisti esogeni) ai neurotrasmettitori endogeni come la serotonina ha portato i ricercatori a prevedere la potenziale attività neurologica di queste molecole. Lo schema dei processi associati alla neurotrasmissione degli agonisti esogeni è descritto nella figura 2.
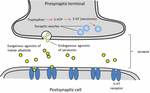
FIGURA 2. Schema dei processi associati alla neurotrasmissione. Agonisti esogeni di alcaloidi indolici da piante che condividono somiglianze di struttura con la serotonina che permette loro di legarsi nei recettori della serotonina (recettori 5-HT).
L’anello indolico è anche conosciuto come bioisosteres e ha simile chimica e fisica come molecole biologiche. Questa somiglianza è usata nello sviluppo del farmaco prototipo che mira a migliorare l’attività farmacologica e ottimizzare il profilo farmacocinetico. In un altro studio di valutazione farmacologica di benzofurani e tienopirrolo ha portato a molecole bioisosteriche che possiedono un’attività simile alla dimetiltriptamina. I primi lavori con benzotiofeni e 3-indenalchilamine hanno dimostrato che per i composti privi di sostituenti dell’anello, la capacità di agire come agonisti nel fondo del ratto era circa la stessa delle triptamine. I risultati hanno rivelato che l’indolo NH non era essenziale per attivare il recettore 5-HT2 nel fondo del ratto (Nichols, 2012). Una serie di antagonisti 2-arilici del recettore NK1 e i loro derivati sono buoni ligandi ma hanno una bassa biodisponibilità orale nei ratti. Al fine di aumentare la solubilità e l’assorbimento, è stato introdotto l’azoto basico, portando all’analogo azaindolo e ai composti correlati che mostrano la stessa affinità di legame NK1 con la serie di antagonisti del recettore NK1 2-arilici (Cooper et al., 2001). Il docking molecolare di 2 ligandi derivati dal fenil-indolo con i recettori della serotonina 5-HT6 e della melanocortina-4 indica che l’impalcatura privilegiata può ospitare a seconda della natura conservata della subpocket e della tasca di legame non conservata. Le interazioni delle parti non conservate della tasca di legame sono responsabili di importanti differenze nel riconoscimento molecolare da parte del recettore bersaglio corrispondente (Bondensgaard et al., 2004).
Secondo de Sa et al. (2009) gli alcaloidi indolici comuni trovati in fonti naturali sono aminoacidi triptofano nell’alimentazione umana e la scoperta di ormoni vegetali che hanno effetti terapeutici come anti-infiammatori, un inibitore della fosfodiesterasi, agonisti e antagonisti del recettore 5-HT, agonisti del recettore dei cannabinoidi e inibitori della HMG-CoA riduttasi. L’impalcatura dell’indolo ha tasche di legame e possiede un dominio di legame complementare comune al recettore bersaglio, che appartiene a una classe di GPCRs (recettori di membrana importanti G-protein accoppiati). La maggior parte dei farmaci sul mercato contiene la sottostruttura indolica. Questi includono l’indometacina, l’ergotamina, il frovatriptan, l’ondansetron e il tadalafil.
Conclusione
Questa revisione ha trovato che la maggior parte dei rimedi a base di piante indicati per il trattamento dei disturbi psichiatrici erano grezzi o semipurificati. I risultati in vivo e in vitro variano e non sono riproducibili perché in diverse regioni biogeografiche il contenuto di metaboliti secondari delle piante è correlato alla disponibilità di nutrienti, al clima e alle condizioni ecologiche. Inoltre, la bioattività delle piante potrebbe essere contribuita da un singolo composto o da una miscela di composti. Gli autori suggeriscono che lo sforzo per ottenere principi attivi, l’identificazione dei fitochimici e lo studio metabolomico dovrebbero essere condotti con ispezioni in vitro e in vivo per una migliore caratterizzazione dei farmaci a base di piante. Nella maggior parte dei casi, la sintesi degli alcaloidi indolici è stata ispirata dalle molecole presenti in natura e dalla loro somiglianza con la serotonina.
Gli alcaloidi indolici da fonti vegetali sono abbastanza complessi rispetto a quelli sintetici. L’importanza degli alcaloidi indolici sintetici è già stabilita in quanto la struttura è disponibile in vari recettori ligandi, inibitori enzimatici e modulatori biorecettoriali. Alcuni degli alcaloidi indolici presenti in natura non possono essere sintetizzati con i metodi attualmente conosciuti. Inoltre, la maggior parte delle informazioni sull’efficacia degli alcaloidi indolici è stata riportata dagli alcaloidi indolici sintetici. Di conseguenza, il potenziale di molti alcaloidi indolici presenti in natura come nuovi farmaci per vari disturbi psichiatrici non è ancora sfruttato. Storicamente, i composti di origine vegetale sono stati la fonte di molte delle piste di droga di maggior successo o dei farmaci utilizzati in medicina. Questo è indicativo del fatto che altri potrebbero essere scoperti.
In conclusione, diversi alcaloidi indolici sono stati impiegati come antidepressivi o forniscono strutture principali per il loro sviluppo. Sulla base delle nostre scoperte, le piante contengono un serbatoio di alcaloidi indolici che sono preziosi punti di partenza per lo sviluppo di futuri antidepressivi.
Contributi degli autori
HH: Preparazione del manoscritto. MY: Modifica della lingua inglese e suggerisce alcune informazioni importanti per migliorare il manoscritto. AR: Contribuire alla comprensione dello schema dei processi associati alla neurotrasmissione.
Finanziamento
Il supporto per questo lavoro è stato fornito dall’Universiti Malaysia Pahang tramite la borsa di ricerca UMP RDU170302 a HH.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Bilia, A. R., Gallori, S., e Vincieri, F. F. (2002). Kava-kava e ansia: conoscenze crescenti sull’efficacia e la sicurezza. Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., and Rodrigues, A. L. S. (2009). La somministrazione di acido ascorbico produce un effetto antidepressivo: prove per il coinvolgimento della neurotrasmissione monoaminergica. Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., e Bywater, R. P. (2004). Riconoscimento di strutture privilegiate da parte di recettori accoppiati a proteine G. J. Med. Chem. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., and Pras, N. (2002). Determinazione di valepotriates. J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., e Yunes, R. A. (2000). Sostanze antinocicettive naturali dalle piante. Phytother. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). Piante e sistema nervoso centrale. Pharmacol. Biochimica. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl indolo antagonisti del recettore NK 1: ottimizzazione della sostituzione indolo. Bioorg. Med. Chem. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., e Alberto, C. (2009). Dalla natura alla scoperta del farmaco: l’impalcatura indolica come “struttura privilegiata”. Mini Rev. Med. Chem. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., e Verpoorte, R. (2007). Catharanthus terpenoid indolo alcaloidi: biosintesi e regolazione. Phytochem. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., e Costa, E. A. (2016). Trattamento di ansia e depressione: piante medicinali in retrospettiva. Fundam. Clin. Pharmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., and Weiss, G. (2011). Studi farmacologici su una combinazione di farmaci a base di erba di San Giovanni (Hypericum perforatum) e passiflora (Passiflora incarnata): prove in vitro e in vivo della sinergia tra Hypericum e Passiflora in modelli farmacologici antidepressivi. Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., and Göthert, M. (2007). 5-HT recettore regolazione del rilascio di neurotrasmettitori. Pharmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., e Jafari, M. (2014). Rigenerazione vegetale efficiente, fedeltà genetica e accumulo di alto livello di due composti farmaceutici in piante rigenerate di Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., e Walden, J. (2001). I pironi di Kava esercitano effetti sulla trasmissione neuronale e sulle correnti di cationi transmembrana simili agli stabilizzatori dell’umore stabiliti – una revisione. Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., and Liu, B.-Y. (2016). Effetti antidepressivi e meccanismi di flavonoidi e analoghi correlati. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., and Winterhoff, H. (2008). Estratti di Valeriana officinalis L. sl mostrano effetti ansiolitici e antidepressivi ma non proprietà sedative o miorilassanti. Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., e Seth, P. (2003). Le piante e il sistema nervoso centrale. Pharmacol. Biochem. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. Effetto antidepressivo di mitraginina isolata da Mitragyna speciosa Korth nel modello di depressione nei topi. Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). Passiflora incarnata L. migliora la memoria spaziale, riduce lo stress e influenza la neurotrasmissione nei ratti. Phytother. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., and Hamann, M. T. (2010). Alcaloidi indolici marini: potenziali nuovi farmaci per il controllo della depressione e dell’ansia. Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., e Intasaro, P. (2007). Immunoreattività Fos-like nei nuclei raphe dorsali di ratto indotta da un estratto alcaloide di Mitragyna speciosa. Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., and Cutler, S. J. (2009). Caratterizzazione fitochimica delle foglie di Mitragyna speciosa coltivata negli USA. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., and Kieser, M. (2001). Efficacia di kava-kava nel trattamento dell’ansia non psicotica, dopo il pretrattamento con benzodiazepine. Psychopharmacology 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., e Dijk, D.-J. (2016). Omeostasi del sonno REM in assenza di sonno REM: Effetti degli antidepressivi. Neuropharmacology 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., e Kothiyal, P. (2015). Depressione e ruolo dei biomateriali marini: una recensione. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). Relazioni struttura-attività degli agonisti della serotonina 5-HT 2A. WIREs Membr. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organizzazione, W. H. (2017). Depression Fact Sheet 2016. Disponibile presso: http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., e Tufik, S. (2002). Può la valeriana migliorare il sonno degli insonni dopo l’astinenza da benzodiazepine? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., e Khan, I. A. (2016). Quantificazione e caratterizzazione degli alcaloidi dalle radici di Rauwolfia serpentina utilizzando la cromatografia liquida ad altissime prestazioni-foto diode array-spettrometria di massa. Anal. Bioanal. Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., e Deed, G. (2009). Il Kava Anxiety Depression Spectrum Study (KADSS): uno studio crossover randomizzato e controllato con placebo che utilizza un estratto acquoso di Piper methysticum. Psychopharmacology 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., e Yamauchi, O. (2009). Complessi metallici che coinvolgono anelli indolici: strutture ed effetti delle interazioni metallo-indolo. Coord. Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., e Nieber, K. (2007). Modulazione dei potenziali postsinaptici in neuroni corticali di ratto da estratti di valeriana macerati con diversi alcoli: coinvolgimento di adenosina A1 e GABAA-recettori. Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). L’uso informale di ketum (Mitragyna speciosa) per l’astinenza da oppioidi negli stati settentrionali della Malesia peninsulare e le implicazioni per la terapia sostitutiva della droga. Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., and Naidu, M. (2016). Mitragyna speciosa leaf extract exhibits antipsychotic-like effect with the potential to alleviate positive and negative symptoms of psychosis in mice. Front. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., and Kong, L.-D. (2008). Antidepressivo-come effetti comportamentali e neurochimici del citrus-associato chimico apigenina. Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar