Background
Artemisia annua è un’erba medicinale cinese (conosciuta anche come “qing hao” o “sweet wormwood”) con provata attività antimalarica (1). Le terapie combinate a base di derivati dell’artemisina (ACT) sono raccomandate dall’Organizzazione Mondiale della Sanità (OMS) per il trattamento della malaria non complicata in combinazione con agenti antimalarici efficaci (2). La chemioprofilassi per i viaggiatori dipende dalla destinazione di viaggio endemica della malaria e comprende una combinazione di aratovaquon/proguanil, clorochina, doxiciclina, meflochina o primachina (3, 4). Sono stati descritti casi di infezione da malaria sotto chemioprofilassi con derivati dell’artemisina (5) e l’OMS non raccomanda l’uso di materiale vegetale A. annua, in qualsiasi forma, incluso il tè, per il trattamento o la prevenzione della malaria (6).
Gli integratori erboristici e dietetici (HDS) sono sempre più utilizzati in tutto il mondo e il danno epatico indotto dagli HDS sta diventando una preoccupazione crescente (7). Nonostante l’ampio uso di ACT nelle aree malariche endemiche, il danno epatico da artemisinina è raro (8, 9). Kumar ha riportato un caso di un paziente che ha sviluppato un danno epatico colestatico 6 settimane dopo l’assunzione di un integratore a base di erbe contenente artemisinina per via orale per il mantenimento della salute generale (10). Ci sono poche altre pubblicazioni relative al danno epatico indotto dall’Artemisia annua (9, 11-14). Una linea guida clinica per valutare la causalità e fare la diagnosi di lesioni epatiche indotte da erbe è stata recentemente proposta dall’Associazione cinese di medicina cinese (15). Presentiamo un caso di epatite colestatica acuta dovuta all’assunzione di tè di Artemisia come chemioprofilassi in un paziente di ritorno dall’Etiopia.
Rapporto del caso
Un uomo di 51 anni si è presentato al dipartimento di emergenza dell’Ospedale Universitario di Basilea, Svizzera con malessere, malessere addominale, feci gialle fluttuanti, ittero e coluria di 4 giorni e una perdita di peso di 6-8 kg nelle ultime 6 settimane. Era tornato da un viaggio di 4 settimane in Etiopia 3 settimane prima di cercare assistenza medica. Durante il suo soggiorno in Etiopia, ha consumato quotidianamente 1,25 g di tè in polvere di Artemisia annua come chemioprofilassi per la malaria. In circa il 90% dei casi ha diluito la polvere in acqua bollente, nel restante 10% la polvere è stata ingerita mescolata al cibo. L’integratore era stato acquistato via Internet. Il paziente ci ha fornito il contenitore, che originariamente conteneva 50 g di una polvere verde scuro (Figura 1). Alla presentazione c’erano 2 g nel contenitore, indicando che aveva consumato un totale di 48 g. Durante il suo soggiorno in Etiopia, aveva consumato anche altri preparati simili al tè. A nostra conoscenza, non c’è nessuna epatotossicità descritta relativa a queste sostanze. Ha negato di aver assunto altri farmaci su prescrizione, da banco o a base di erbe. Non aveva una storia precedente o familiare di malattia del fegato, abuso di alcol o droghe, o fattori di rischio per l’epatite virale. Ha riferito che sua moglie, che lo ha accompagnato nel suo viaggio in Etiopia, aveva anche consumato il tè Artemesia annua per la profilassi della malaria. È rimasta bene per tutto il tempo.

Figura 1. Tè di polvere di Artemisia annua.
A parte un ittero marcato, era in buone condizioni generali e aveva segni vitali irrilevanti (afebrile con pressione sanguigna, frequenza cardiaca e frequenza respiratoria normali).
I test di laboratorio hanno mostrato: alanina aminotransferasi (ALAT) 91 U/L (normale, 9-59); aspartato aminotransferasi (ASAT) 42 U/L (normale, 9-34); fosfatasi alcalina (ALP) 151 U/L (normale, 40-130); gamma-glutamil transferasi (GGT) 416 U/L (normale, 12-68); bilirubina totale 186.6 μmol/L (normale, 0-24) (bilirubina coniugata 168.5 μmol/L); e rapporto internazionale normalizzato (INR) 0.9 (normale, 0.9-1.3). Il livello degli acidi biliari è stato elevato al livello di 460.5 μmol/L (normale, 0-8.0). L’emocromo differenziale e la proteina c-reattiva erano normali. Lieve iponatremia e ipocloremia erano presenti, coerentemente con l’aumento dell’assunzione di acqua del paziente nei giorni precedenti. I test sierologici per l’epatite acuta A, B, C ed E, il virus Epstein-Barr e l’infezione da citomegalovirus erano negativi. La coeruloplasmina era normale. Gli auto-anticorpi specifici del fegato (anticorpo anti-nucleo, anticorpo anti-neutrofilo, anticorpo anti-muscolo liscio, anticorpo anti-mitocondriale, anticorpo anti-proteinasi 3 e anticorpo anti-mieloperossidasi) erano negativi e le IgA, IgM e IgG erano nel range normale. L’ecografia addominale ha mostrato un normale parenchima epatico, vasi e condotti biliari. L’elastografia epatica era elevata (FibroScan, 12,7 kPa, range normale <5 kPa).
Il paziente è stato anche valutato presso l’Istituto svizzero di salute pubblica e tropicale per varie potenziali condizioni infettive sottostanti. Gli anticorpi contro la rickettsia spotted fever erano positivi, tuttavia, questo è stato considerato non correlato alla presentazione clinica e nessuna terapia antibiotica è stata iniziata.
La biopsia epatica iniziale ha mostrato un’epatite portale con infiltrazione linfocitica dei dotti biliari e bilirubinostasi intra-canalare e intra-citoplasmatica diffusa. Non si è vista né fibrosi né materiale parassitario (figure 2A,B). Un’analisi di next generation sequencing sul DNA dei leucociti del sangue periferico per varianti genetiche nei geni che codificano i 3 più importanti trasportatori epatici per l’omeostasi degli acidi biliari, cioè BSEP, MDR3 e FIC1, non ha trovato varianti tipicamente associate a malattie epatiche colestatiche ereditarie.
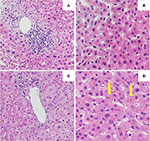
Figura 2. Istologia della prima (A,B) e seconda (C,D) biopsia epatica. (A) Vista a bassa potenza della biopsia epatica che mostra un infiltrato linfocitario portale. (B) Parenchima epatico con bilirubinostasi intracellulare (HE, 20x). (C) Vista a bassa potenza della biopsia epatica senza infiammazione portale significativa (HE, 10x). (D) Parenchima epatico con bilirubinostasi intracellulare ed extracellulare significativa (freccia) (HE, 20x).
L’analisi tossicologica del tè di Artemisia mediante cromatografia liquida-spettrometria di massa e gascromatografia-spettrometria di massa ha rivelato i seguenti ingredienti: arteannuin b, deoxyartemisin, canfora e scopoletin.
È stato iniziato un trattamento con prednisone 20 mg due volte al giorno e acido ursodeossicolico 500 mg due volte al giorno. A causa del persistente ittero e dell’aumento della bilirubina per 4 settimane nonostante il trattamento, fu eseguita una seconda biopsia epatica. La seconda biopsia ha mostrato una grave bilirubinostasi intracitoplasmatica e intracanalicolare, con un’infiammazione minima rispetto alla prima biopsia (Figure 2C,D). Il trattamento con corticosteroidi è stato interrotto, l’acido ursodeossicolico è stato continuato fino alla risoluzione dell’ittero e alla normalizzazione della bilirubina (15,3 μmol/l) (Figura 3) e alla diminuzione rilevante degli acidi biliari (19,5 μmol/l), avvenuta tre mesi dopo l’inizio della malattia.
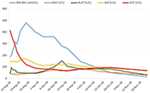
Figura 3. Andamento della bilirubina e degli enzimi epatici nel tempo.
Il caso è stato segnalato all’unità di farmacovigilanza dell’autorità nazionale svizzera per gli agenti terapeutici (Swissmedic). Il consenso informato scritto è stato ottenuto dal partecipante per la pubblicazione di questo case report.
Discussione
I derivati dell’artemisina sono una pietra miliare per il trattamento ma non la chemioprevenzione della malaria (2). Nonostante il loro ampio uso, il danno epatico da artemisinina-derivati è stato raramente descritto (8, 10). Per quanto ne sappiamo, questo è il primo caso di epatite colestatica acuta dovuta all’assunzione di tè Artemisia annua.
La lesione epatica indotta da integratori erboristici e dietetici è un argomento di crescente interesse poiché gli HDS sono sempre più utilizzati in tutto il mondo (7). L’assunzione di HDS è spesso considerata innocua, tuttavia, è stato riportato un numero crescente di eventi avversi che si verificano insieme al loro uso (16). Inoltre, poiché la concentrazione e la composizione delle HDS spesso non sono dichiarate sulle etichette dei prodotti, la qualità e la quantità degli ingredienti del prodotto rimangono sconosciute. Nel nostro caso, la diagnosi di danno epatico indotto da HDS dovuto all’assunzione di tè Artemisia annua si è basata sulla forte relazione temporale tra l’esposizione e lo sviluppo della reazione avversa e l’assenza di altre possibili eziologie. Abbiamo calcolato il punteggio di valutazione della causalità secondo il RUCAM (Roussel Uclaf Causality Assessment Method) (17) e abbiamo ottenuto un punteggio di 6 corrispondente a una causalità “probabile” del farmaco incriminato. Le diverse voci sono state valutate come segue: tempo di insorgenza (+2), decorso (+1), fattori di rischio (+1), farmaci concomitanti (-1), esclusione di altre cause di danno epatico (+2), informazioni precedenti sull’epatotossicità del farmaco (+1), risposta alla risomministrazione (0). Non c’erano altre eziologie identificabili di malattia epatica.
Il caso precedentemente descritto da Kumar ha presentato un modello epatocellulare di danno epatico, seguito da una fase colestatica prolungata (10). Il nostro paziente ha presentato un modello prevalentemente colestatico di lesione epatica 5 settimane dopo la prima ingestione di tè Artemisia annua. Presumiamo che la storia naturale era simile al caso di Kumar, ma che il nostro paziente ha presentato in una fase successiva durante l’evoluzione del danno epatico. Nell’analisi tossicologica della tisana ingerita abbiamo identificato inoltre scopoletina e canfora, che si trovano naturalmente in Artemisia annua (18, 19) e possono aver contribuito all’insorgenza del danno epatico colestatico.
Il meccanismo del danno epatico indotto dall’artemisina-derivato rimane poco chiaro. I componenti chimici di Artemisiae spp includono oli volatili, flavonoidi, tannini, triterpeni e polisaccaridi. Gli oli volatili di Artemisiae spp hanno forti attività farmacologiche e tossicità, e un recente approccio bioinformatico ha identificato vari percorsi che possono essere coinvolti nello sviluppo del danno epatico (20). La predisposizione al danno epatico colestatico indotto da farmaci è stata associata ai polimorfismi della pompa di esportazione dei sali biliari (21, 22). Abbiamo quindi cercato varianti nei trasportatori degli acidi biliari con il sequenziamento della prossima generazione. Non abbiamo rilevato una delezione, duplicazione o variante patologica nelle sequenze dei geni ABCB11, ATP8B1 e ABCB4 (regioni codificanti e laterali) che codificano rispettivamente per BSEP, FIC1 e MDR3 (Figura 4). Tuttavia, sono state identificate alcune varianti di sequenza comuni. Il nostro paziente portava omozigote una variante del gene ABCB11. È stato discusso se questo polimorfismo sia associato alla colestasi intraepatica familiare benigna ricorrente e/o progressiva e alla colestasi intraepatica della gravidanza (23, 24). Inoltre, un’altra variante comune nel gene ABCB11 è stata rilevata in stato eterozigote. Questa variante è stata associata a una ridotta espressione della proteina (25) e alla cirrosi biliare primaria (26, 27). Tuttavia, entrambe le varianti genetiche sono troppo frequenti nella popolazione generale per essere causali per le malattie epatiche colestatiche (28). Il sequenziamento sistematico del trascrittoma in questi casi può identificare varianti in altre regioni delle sequenze geniche o in altri geni che codificano per altri trasportatori epatici o proteine coinvolte nella generazione della bile, come ABCC2, ABCC3, ABCC4, e la proteina della giunzione stretta 2 (TJP2), rispettivamente (21).
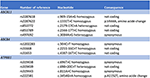
Figura 4. Analisi genetica molecolare dei geni ABCB11, ABCB4 e ATP8B1.
In conclusione, descriviamo un caso di grave lesione epatica colestatica indotta da HDS compatibile con l’assunzione di tè Artemisia annua. Gli sforzi dovrebbero essere intrapresi per scoraggiare l’uso di artemisina-derivati per la prevenzione della malaria, che è inefficace secondo le raccomandazioni dell’OMS e può inoltre causare danni. Inoltre, il caso dimostra la nostra comprensione ancora inadeguata della fisiopatologia e della suscettibilità al danno epatico indotto da HDS.
Data Availability Statement
Tutti i set di dati per questo studio sono inclusi nel manoscritto/file supplementari.
Ethics Statement
La revisione etica e l’approvazione non sono state richieste per il rapporto di un singolo caso clinico in conformità alla legislazione locale e ai requisiti istituzionali. Il paziente/partecipante ha fornito il suo consenso informato scritto a partecipare.
Contributi degli autori
FR-R ha scritto la prima bozza del manoscritto. SH, CB, AL-T, MZ e AJ hanno scritto sezioni del manoscritto. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT, e CB hanno contribuito alla gestione clinica del paziente, alla revisione del manoscritto, hanno letto e approvato la versione presentata.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
1. Klayman DL. Qinghaosu (artemisinina): un farmaco antimalarico dalla Cina. Scienza. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Organizzazione Mondiale della Sanità. WHO Guidelines for the Treatment of Malaria, 2nd ed. (2010). Disponibile online a: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (accesso 23 novembre 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Disponibile online a: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (accesso 23 novembre 2018).
Google Scholar
4. Centers for Disease Control and Prevention. Scegliere un farmaco per prevenire la malaria (2018). Disponibile online a: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Uso improprio di Artesunate e malaria da falciparum Plasmodium nel viaggiatore di ritorno dall’Africa. Emerg Infect Dis. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Organizzazione Mondiale della Sanità. OMS, dichiarazione di posizione. Efficacia delle forme non farmaceutiche di Artemisia annua L. contro la malaria. Ginevra: Organizzazione Mondiale della Sanità (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Lesioni al fegato da integratori alimentari e a base di erbe. Hepatology. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Due casi di epatite fulminante durante un trattamento curativo con una combinazione artesunato-amodiachina. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centers for Disease Control and Prevention (CDC). Epatite associata temporaneamente con un integratore a base di erbe contenente artemisinina – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Lesione epatica colestatica secondaria all’artemisinina. Epatologia. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. Un pilota randomizzato, placebo-controllato studio clinico per indagare l’efficacia e la sicurezza di un estratto di Artemisia annua somministrato oltre 12 settimane, per la gestione del dolore, rigidità e limitazione funzionale associata a osteoartrite dell’anca e del ginocchio. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Rischio potenziale di danno al fegato – Dichiarazione ai sensi della sezione 98 del Medicines Act 1981 (2018). Disponibile online a: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, Informazioni cliniche e di ricerca sulla lesione epatica indotta da farmaci. Derivati dell’artemisinina. (2019). Disponibile online a: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicity with a Natural Dietary Supplement, Artemisia annua L. Extract in Grapeseed Oil. Rapporti del centro di farmacovigilanza della Nuova Zelanda. Sicurezza dei farmaci (2018). In: 18th ISoP Annual Meeting “Pharmacovigilance without borders”. Ginevra (accesso 11-14 novembre 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Linee guida per la diagnosi e la gestione della lesione epatica indotta dalle erbe. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Tendenze nell’uso di approcci di salute complementare tra gli adulti: Stati Uniti, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM nel danno epatico indotto da farmaci ed erbe: l’aggiornamento. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Differenze nei costituenti chimici di Artemisia annua L da diverse regioni geografiche in Cina. PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variazioni nei componenti antimalarici di Artemisia annua Linn da tre regioni dell’Uganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Molecular network-based analysis of the mechanism of liver injury induced by volatile oils from Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. L’interferenza con la funzione della pompa di esportazione dei sali biliari è un fattore di suscettibilità per il danno epatico umano nello sviluppo di farmaci. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. La pompa di esportazione bile sal (BSEP) in salute e malattia. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Aggiornamento sulla colestasi intraepatica familiare progressiva. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. La genetica molecolare della colestasi intraepatica della gravidanza. Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. Il ruolo del polipeptide cotrasportatore di sodio-taurocholato (NTCP) e della pompa di esportazione dei sali biliari (BSEP) nella fisiologia e fisiopatologia della formazione della bile. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. BSEP e struttura aplotipo MDR3 in caucasici sani, cirrosi biliare primaria e colangite sclerosante primaria. Epatologia. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Variazioni di ABCB4 e ABCB11 geni sono associati con calcoli intraepatici primari. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. Sequenziamento di FIC1, BSEP e MDR3 in una grande coorte di pazienti con colestasi ha rivelato un elevato numero di diverse varianti genetiche. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar