1. Permeabilità
2. Fluidità
3. Eterogeneità
– Interna
– Esterna
– Flessione, spessore
Le funzioni delle membrane cellulari sono determinate dalla loro composizione molecolare. Il tipo e la proporzione di queste molecole stabiliranno le caratteristiche fisico-chimiche della membrana: semipermeabilità, asimmetria, fluidità, riparazione e riciclaggio.
Permeabilità
La semipermeabilità delle membrane è una conseguenza dell’ambiente idrofobico interno delle membrane, creato dalle catene di acidi grassi dei lipidi, che è difficile da attraversare per le molecole con cariche elettriche. Così, impedendo la libera diffusione delle molecole, le membrane possono formare compartimenti che mantengono distinti gli ambienti interni ed esterni. Tuttavia, la permeabilità è selettiva. La polarità e la dimensione sono le caratteristiche molecolari più importanti che influenzano la capacità di attraversare le membrane. Piccole molecole senza cariche elettriche, come CO2, N2, O2, e molecole con alta solubilità nei grassi come l’etanolo, possono attraversare le membrane quasi liberamente per diffusione passiva (Figura 1). La permeabilità è inferiore per le molecole che hanno cariche elettriche quando il numero di cariche positive è uguale alle cariche negative, note come molecole senza carica, come l’acqua e il glicerolo. Si potrebbe pensare che l’acqua possa attraversare liberamente le membrane, ma ci sono alcune restrizioni, ed è per questo che alcune membrane contengono acquaporine, un tipo di proteina transmembrana con un canale che permette all’acqua di attraversare liberamente. La capacità delle grandi molecole senza carica, come il glucosio, di attraversare le membrane è bassa. Le membrane sono altamente impermeabili agli ioni e alle molecole cariche. Alcuni valori per il coefficiente di permeabilità per diffusione passiva sono: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glicerolo: 10 -6 cm/s, sodio e potassio: 10 -14 cm/s.
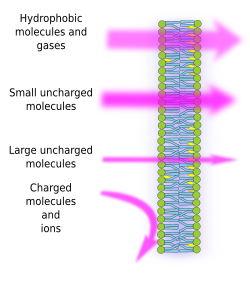
La distribuzione ineguale di ioni e molecole tra i due lati di una membrana permette di generare e mantenere gradienti elettrochimici. La differenza tra la concentrazione interna ed esterna delle cariche elettriche è conosciuta come potenziale di membrana. Questo gradiente è usato per molte funzioni cellulari, come la sintesi di ATP e la trasmissione di informazioni lungo i nervi. La semipermeabilità è anche responsabile dei processi osmotici, che sono movimenti di acqua attraverso le membrane da una soluzione meno concentrata in un lato a una soluzione più concentrata nell’altro lato, al fine di eguagliare entrambe le concentrazioni. In questo modo, le cellule vegetali sono in grado di aumentare di dimensioni grazie a una maggiore concentrazione intracellulare di alcuni soluti che fanno entrare acqua nella cellula, che a sua volta produce una pressione idrostatica interna (chiamata pressione di turgore) che spinge le pareti cellulari verso l’esterno. Le molecole che non attraversano liberamente le membrane sono utili alle cellule perché possono creare gradienti che possono funzionare come meccanismi di informazione o come riserve di energia. Le cellule hanno proteine transmembrana che permettono di attraversare la membrana o spostare molecole cariche e ioni tra entrambi i lati delle membrane cellulari, evitando l’ambiente idrofobico della membrana interna. Per esempio, la contrazione muscolare è innescata dall’apertura di canali che riducono un gradiente ionico esistente.
La semipermeabilità è influenzata dalla composizione lipidica delle membrane. Per esempio, il contenuto di colesterolo è importante nella membrana plasmatica. Un aumento del contenuto di colesterolo diminuisce la fluidità e aumenta l’idrofobicità, entrambe caratteristiche che rendono la membrana più impermeabile. Così, l’aumento del colesterolo oltre il 30% (che è un valore elevato) rende le membrane mieliniche molto adatte a isolare gli assoni e a ottimizzare la propagazione del potenziale d’azione lungo l’assone.
Fluidità e domini laterali
La fluidità è una proprietà delle membrane. È legata alla capacità delle molecole di muoversi all’interno delle membrane. Una maggiore fluidità significa che i movimenti sono più frequenti. Le membrane cellulari sono in realtà un foglio di grasso, dove le molecole sono in uno stato viscoso semi liquido. Così, si può intuire che le molecole possono muoversi per diffusione. Per esempio, un glicerofosfolipide situato nel monostrato esterno della membrana plasmatica può avere due tipi di movimenti: laterale, cioè nello stesso monostrato, e flip-flop, cioè saltando da un monostrato all’altro (figura 2). Nelle membrane artificiali, questi due tipi di movimenti sono stati osservati, essendo i movimenti laterali molto più frequenti del flip-flop. Per diffusione laterale, i lipidi possono percorrere 30 µm in 20 secondi; possono percorrere l’intera circonferenza di una cellula di medie dimensioni in un minuto. Tuttavia, i movimenti flip-flop sono davvero poco frequenti perché la testa idrofila della molecola lipidica deve attraversare lo strato interno di catene di acidi grassi, e questo è termodinamicamente difficile. Per una molecola lipidica, la probabilità di uno spostamento flip-flop è di circa una volta al mese. Tuttavia, il colesterolo si comporta diversamente e può fare flip-flop abbastanza facilmente.

La fluidità delle membrane può cambiare a seconda della composizione chimica. In generale, catene di acidi grassi più corte e una maggiore quantità di legami insaturi tra i carboni degli acidi grassi aumentano la fluidità di membrana. Anche la quantità di colesterolo influenza la fluidità di membrana, ma l’effetto netto dipende dalla temperatura e dal tipo di lipidi nella membrana. Il colesterolo ha due effetti: inibisce la transizione allo stato di gel solido (meno fluidità), ma diminuisce anche la flessibilità delle catene insature degli acidi grassi. In generale, si può dire che un aumento della concentrazione di colesterolo diminuisce la fluidità della membrana, anche se a basse temperature l’effetto è opposto. Le membrane interne della cellula, come quelle del reticolo endoplasmatico, contengono molto poco colesterolo e quindi sono più fluide. Inoltre, il colesterolo fornisce alle membrane un’altra proprietà nota come idrofobicità, che rende le membrane più impermeabili.
La diversa composizione molecolare tra i due monostrati di una membrana, nota come asimmetria di membrana, può generare una fluidità distinta in ogni monostrato. A seconda della composizione molecolare, i lipidi possono trovarsi in due fasi fisiche: liquido-ordinato (meno fluidità) e liquido-disordinato (più fluidità). Si suppone che il monostrato esterno della membrana plasmatica sia più frequentemente nella fase liquida-ordinata, mentre il monostrato interno tende ad essere in fase liquida-disordinata.
Le cellule possono modificare la fluidità delle membrane cambiando la loro composizione chimica. Per esempio, i batteri regolano la saturazione e la lunghezza delle catene di acidi grassi in modo che la fluidità della membrana possa essere adattata alle condizioni ambientali. Anche la variazione della concentrazione di glicerofosfolipidi, come la fosfatidiletanolamina, può modulare la fluidità. Alcuni insetti non possono sintetizzare steroli, come il colesterolo, e gli steroli delle loro membrane provengono dal cibo. Essi modificano la fluidità delle loro membrane cellulari con diverse concentrazioni di fosfatidiletanolamina.
La membrana interna dei mitocondri deve essere una forte barriera impermeabile per creare e mantenere un gradiente protonico. Ciò potrebbe essere fatto con un aumento del contenuto di colesterolo. In questo modo l’idrofobicità è maggiore, ma a sua volta il colesterolo diminuisce la fluidità, che sembra essere molto importante per la funzione delle proteine in questa membrana. I mitocondri risolvono il problema con la cardiolipina, un fosfolipide insaturo che aumenta l’idrofobicità, ma non riduce molto la fluidità della membrana.
3. Eterogeneità
A causa della fluidità, si può pensare che le proteine siano distribuite in modo casuale e, quindi, le membrane sono omogenee per quanto riguarda la composizione molecolare, cioè, mostrano lo stesso contenuto molecolare e la stessa proporzione indipendentemente dalla regione della membrana. Questo non è vero. Ci sono restrizioni alla diffusione laterale delle molecole che causano l’eterogeneità della membrana, il che significa che ci sono regioni di una membrana con diversa composizione molecolare. Nelle cellule non polarizzate, e su scale più grandi di 200 nm, la membrana plasmatica sembra omogenea, ma su scale inferiori a 200 nm è eterogenea. Si pensa che i microdomini delle membrane abbiano una dimensione di circa 60 µm. I lipidi e le proteine mostrano movimenti laterali per lo più limitati ad aree di 60-200 nm durante alcuni millisecondi, e poi saltano in un’altra area adiacente dove rimangono per un altro breve periodo. Questo comportamento è chiamato diffusione saltatoria.
Le restrizioni ai movimenti laterali delle molecole possono essere causate da diversi meccanismi: interazioni con il citoscheletro o la matrice extracellulare, interazioni delle molecole di membrana tra di loro, diverse densità delle aree locali di membrana (cambiamenti di fluidità), quantità di cariche elettriche, curvatura della membrana e diverso spessore dei domini di membrana (Figura 3).
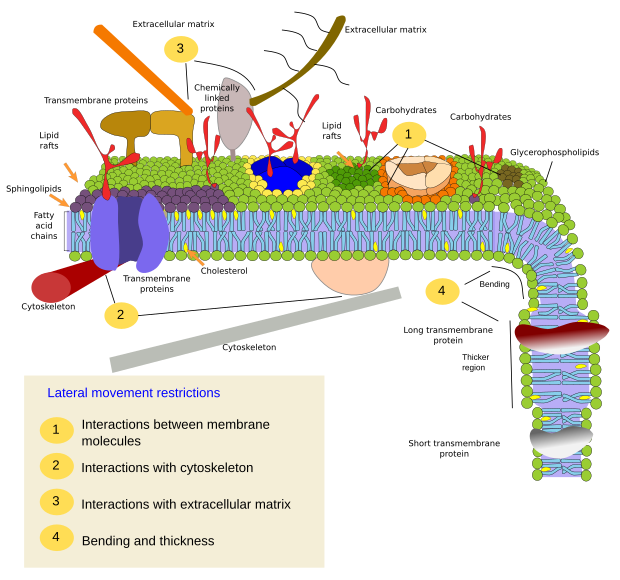
Interazioni interne
Le interazioni delle molecole di membrana tra loro limitano il movimento laterale. Entrambi i movimenti delle proteine e dei lipidi sono influenzati da queste interazioni che portano alla formazione di microdomini con composizione molecolare differenziale (Figura 4). Il risultato è una distribuzione laterale eterogenea delle molecole nelle membrane. A seconda delle proporzioni molecolari, i microdomini lipidici possono avere diverse densità (cioè fluidità): solido, liquido ordinato e liquido disordinato. La densità più comune è il liquido disordinato, che è il più fluido.
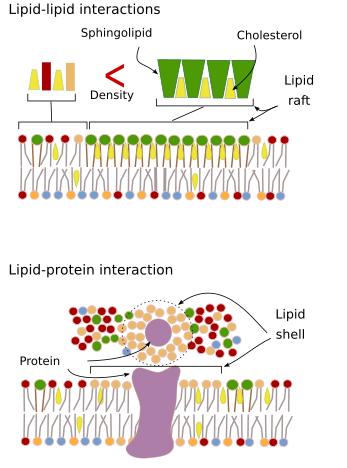
Sfingolipidi e colesterolo possono associarsi spontaneamente tra loro, riducendo la loro motilità e aumentando la densità molecolare rispetto alle aree vicine. Un piccolo gruppo distinto di molecole si forma come una zattera in un mare di lipidi. In realtà, queste associazioni molecolari sono conosciute come zattere lipidiche, e si pensa che siano molto abbondanti e nelle membrane cellulari. Le zattere lipidiche mostrano un comportamento altamente dinamico, possono muoversi, crescere, diminuire, apparire e scomparire. In effetti, le membrane sono costituite da molti domini densi che viaggiano lateralmente tra i glicerofosfolipidi, così che le membrane sono abbastanza eterogenee per quanto riguarda la loro distribuzione molecolare. Alcuni esperimenti suggeriscono che certi tipi di proteine si “sentono” più a loro agio all’interno dei rafts lipidici. Queste proteine passano più tempo all’interno che all’esterno dei rafts lipidici, quindi viaggiano per un certo tempo all’interno di queste densità. Questo provoca una segregazione delle molecole lungo la membrana, e aumenta la probabilità che molecole diverse siano vicine l’una all’altra più tempo che per caso (diffusione), aumentando così la probabilità di certe reazioni molecolari. Inoltre, si suggerisce che un’alta concentrazione di certi tipi di lipidi nelle zattere lipidiche crea un ambiente chimico distinto che facilita alcune reazioni chimiche o interazioni molecolari. Le zattere lipidiche sono state proposte per essere presenti nel monostrato esterno della membrana plasmatica perché è in questo lato che gli sfingolipidi sono abbondanti. È stato suggerito che i domini di membrana esistano anche nelle membrane degli organelli, e si pensa che alcune delle loro funzioni dipendano da questi domini di membrana.
Nel monostrato interno della membrana plasmatica, i microdomini sono formati da interazioni elettrostatiche tra domini citosolici di base o domini di cationi divalenti delle proteine e le teste polari negative dei lipidi. Un altro esempio meno conosciuto è l’associazione tra fosfatidilinositolo bisfosfato e colesterolo che forma microdomini in questo monostrato. Questi microdomini rivolti verso il citosol possono influenzare le impalcature proteiche intracellulari.
Tradizionalmente, si è pensato che non ci sono interazioni tra i due monostrati di membrane e che essi distribuiscono i loro microdomini in modo indipendente. Tuttavia, le evidenze suggeriscono che ci sono interazioni tra loro. Le proteine transmembrana influenzano simultaneamente entrambi i monostrati poiché attraversano l’intera membrana. Un altro modo di sincronizzazione tra i due monostrati può essere mediato dalle lunghe catene di acidi grassi, come alcuni sfingolipi che possono essere di 24 carboni di lunghezza (la lunghezza normale è 18). Queste lunghe catene possono essere inserite tra le catene di acidi grassi dei lipidi dell’altro monostrato e influenzare la distribuzione lipidica. Inoltre, si pensa che i domini lipidici con lunghe catene di acidi grassi siano controbilanciati da microdomini lipidici a catena di acidi grassi corta nell’altro monostrato, mantenendo costante lo spessore della membrana.
Le proteine di membrana, sia integrali che associate, possono anche interagire tra loro e assemblarsi in impalcature macromolecolari per facilitare la trasmissione di informazioni, il riconoscimento cellula-cellula, avviare alcune attività enzimatiche e il movimento cellulare. Ci sono anche proteine multimeriche attive solo quando tutte le subunità sono tenute insieme. Per esempio, il recettore dell’insulina è composto da quattro subunità. Proteine e lipidi possono anche interagire per formare domini di membrana. Per esempio, nel monostrato interno, il fosfatidilinositolo si associa intorno alle proteine mediante interazioni elettriche, che possono essere regolate modificando i fosfati della testa polare dei lipidi.
Interazioni con elementi esterni
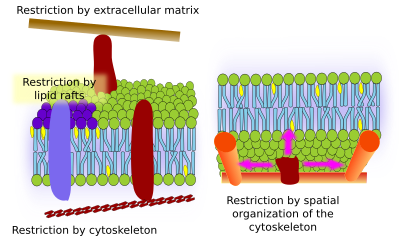
Anche le proteine di membrana integrale possono avere movimenti laterali, ma sono più limitate dei lipidi, soprattutto a causa delle interazioni con la matrice extracellulare e il citoscheletro attraverso i loro domini extracellulari e intracellulari, rispettivamente (Figura 5). Queste interazioni possono mantenere le proteine in piccole aree della membrana per più tempo rispetto alla semplice diffusione. Il citoscheletro può formare recinti appena sotto la membrana plasmatica che mantengono le proteine limitate in piccole aree. I filamenti di actina e i microtubuli possono racchiudere piccole aree che limitano la diffusione di proteine e lipidi. Le interazioni con il citoscheletro sono importanti perché se il citoscheletro è sperimentalmente disorganizzato la membrana diventa molto più omogenea. Le cellule hanno altri meccanismi per confinare le proteine in domini specifici. Per esempio, le cellule epiteliali intestinali hanno alcuni trasportatori ed enzimi situati nella membrana plasmatica apicale, ma non nel dominio baso-laterale a causa di una cintura di giunzioni strette, una cerniera molecolare che impedisce la diffusione tra il dominio apicale e quello baso-laterale. Tale distribuzione asimmetrica è essenziale per la fisiologia della cellula epiteliale.
La curvatura della membrana è un altro modo per creare microdomini. Una curvatura della membrana può essere il punto di partenza per formare una vescicola, un’estensione del citoplasma per l’espansione cellulare, un cambiamento di forma o la crescita di un organello, o semplicemente per iniziare una barriera per limitare il movimento laterale delle molecole. Questa è una restrizione fisica attraverso la disposizione 3D dei lipidi nell’angolo più piccolo della piega della membrana.
Gli strumenti molecolari necessari per piegare una membrana sono reclutati in regioni specifiche della membrana. Questi microdomini possono avere una composizione lipidica specifica o un particolare ambiente di carica elettrica. I fosfoinositidi (PIP), soprattutto i PIP2 e i PIP3, sono lipidi che contribuiscono al reclutamento delle proteine per piegare la membrana. Sono molecole utili perché la carica elettrica e la struttura molecolare delle loro teste polari possono essere facilmente modificate da reazioni chimiche. In questo modo, le proprietà di una particolare regione della membrana possono cambiare quando necessario e reclutare proteine specifiche. La fosfatidilserina è anche in grado di avviare un microdominio per la piegatura della membrana quando viene traslocato da un monostrato all’altro dalle flipasi.
Curvatura e spessore
I microdomini lipidici reclutano proteine che effettivamente piegano la membrana. Ci sono proteine specializzate in questo ruolo (Figura 6). Le proteine del dominio BAR (Bin/amfisina/Rsv161) sono una di queste. La piegatura può essere indotta da due meccanismi: l’assemblaggio di un’impalcatura curva di proteine che tirano o spingono la membrana, e l’inserimento di sequenze di aminoacidi tra i lipidi come un cuneo. Per esempio, le caveoline causano la curvatura della membrana per formare le cavele, la tetraspina forza le membrane per formare i tubuli, l’ESCRT aiuta la formazione delle vescicole all’interno degli endosomi per formare i corpi multivascolari. L’actina è un forte agente di curvatura della membrana attraverso la polimerizzazione dei filamenti di actina che spinge la membrana plasmatica verso l’esterno portando ad espansioni cellulari. Molte proteine che possono curvare la membrana plasmatica attivano anche la polimerizzazione dell’actina.
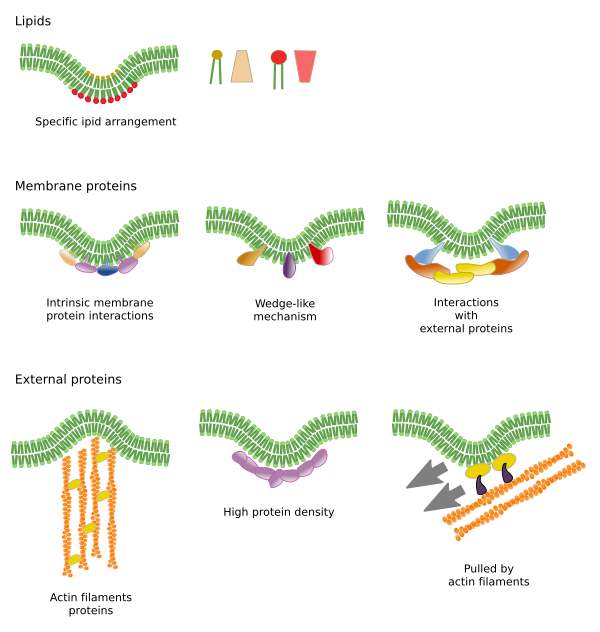
Ci sono altri domini nelle membrane, domini fisici, formati da molecole come le proteine transmembrana. Queste aree mostrano un diverso spessore della membrana perché contengono proteine con sequenze di aminoacidi più lunghe e idrofobiche che vengono circondate da lipidi con catene di acidi grassi più lunghe (Figura 7). Queste proteine e lipidi si “sentono” più a loro agio quando sono insieme, poiché si adattano correttamente alle loro parti idrofobiche. Formano domini di membrana che escludono altre molecole, sia proteine che lipidi, con regioni idrofobiche più corte.

Bibliografía
Honigmann A, Pralle A. (2016). Compartimentalizzazione della membrana cellulare. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Curvatura di membrana in biologia cellulare: un’integrazione dei meccanismi molecolari. Giornale di biologia cellulare. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Colesterolo alto/basso colesterolo: effetti in biologicalmembranes: una revisione Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.