Introduction
Az Egészségügyi Világszervezet szerint a depresszió világszerte mintegy 350 millió embert érint (Organization, 2017). A depressziós betegek a szorongásos zavarok tüneteit jelzik, és az öröm és az érdeklődés megélésének képtelenségével, koncentrációvesztéssel, önbizalomhiánnyal, szociális szorongással, alvás- és étvágytalansággal járnak együtt (Namola et al., 2015). A depressziót okozó fő tényezők az agyban lévő vegyi anyagok vagy hormonok kiegyensúlyozatlansága. A depresszióval összefüggésbe hozott fő hormon a szerotonin. További hormonok a noradrenalin és a dopamin (Yi et al., 2008). Ezek a hormonok szükségesek a normális agyműködéshez és az érzések szabályozásához. Ezeknek a hormonoknak a pusztulása kémiai egyensúlyhiányt okozhat az agyban, ami depresszióhoz vezethet.
A depresszió súlyosságától függően pszichoterápiával vagy gyógyszeres kezeléssel kezelhető. Az antidepresszánsok a depresszió kezelésére használt gyógyszerek fő típusai. Számos különböző típusú antidepresszáns gyógyszer áll rendelkezésre, és csak abban különböznek, ahogyan az agyra hatnak, a költségükben és a mellékhatásprofiljukban. Az első vonalbeli kezelésben a legtöbb betegnek vagy triciklikus antidepresszánst (TCA) vagy szelektív szerotonin visszavétel gátlót (SSRI; McCarthy és mtsi., 2016) írnak fel. A szorongás kezelésére gyakran alkalmazott gyógyszerek a benzodiazepinek. Bár a piacon számos antidepresszáns gyógyszer van forgalomban, amelyeket a depresszió kezelésére használnak, e gyógyszerek használatának utóhatásai nagy aggodalomra adnak okot (Binfaré és mtsai., 2009). A depresszió alternatív terápiája a növényi gyógyszerek alkalmazása (Fajemiroye et al., 2016). A gyógynövénykivonatok használata egyre szélesebb körű elfogadottságot élvez az orvosi szakma és a betegek körében. A depresszió kezelésére használt növényi szerek többsége nyers vagy félig tisztított kivonat (Calixto et al., 2000; Carlini, 2003; Guan és Liu, 2016).
A központi idegrendszerre (CNS) aktivitást kiváltani képes hatóanyagot tartalmazó kutatásokról szóló jelentések hiányosak. Carlini (2003) áttekintése csak a pszichoanaleptikus, pszicholeptikus és pszichodiszleptikus hatásokról tartalmaz információkat. Guan és Liu (2016) nemrégiben megjelent áttekintése a természetes és szintetikus forrásokból izolált flavonoidok antidepresszáns hatásainak szerkezet-aktivitás kapcsolatát tárgyalta. A szintetikus indol-alkaloidokat, aktivitásukat és lehetséges gyógyászati felhasználásukat már több cikkben is áttekintették (de Sa és mtsai., 2009). Nem jelent meg azonban olyan áttekintő cikk, amely az izolált növényi indol-alkaloidokat antidepresszáns aktivitással hozta volna összefüggésbe. Ez az áttekintés a természetes indol-alkaloidok neurológiai rendellenességek kezelésében rejlő lehetőségekről, szerkezet-aktivitás összefüggés-vizsgálatokról és ezek más bioaktív metabolitokhoz, mint potenciális antidepresszáns hatóanyag-vezető anyagokhoz való viszonyáról nyújt információt a kémiai szerkezet szempontjából. Összeállítása tudományos folyóiratok bibliográfiai vizsgálata és a Web of Science elektronikus adatbázisokon keresztül azonosított releváns irodalom alapján történt.
Antidepresszáns növények
Ez az áttekintő cikk a központi idegrendszerre ható aktivitással rendelkező növényekkel foglalkozik. Bár számos növénytípus tartozik ebbe a kategóriába, mi csak azokat a növényeket emeljük ki, amelyek antidepresszáns tulajdonságokkal rendelkeznek. Két olyan növény, amely indol-alkaloidokat tartalmaz, a Passiflora incarnata L. (passióvirág) és a Mitragyna speciosa (Korth.) Havil (kratom), míg a másik két növény, amely nem mutatott ki indol-alkaloidok jelenlétét, a Piper methysticum G. Forst (kava) és a Valeriana officinalis L. külön figyelmet érdemel. Az ezekből a növényekből izolált vegyületek kémiai szerkezete új gyógyszerek kifejlesztésének alapjául szolgálhat.
A Passiflora incarnata és más fajok, mint a P. alata Curtis, a P. coerulea L. és a P. edulis Sims a hagyományos gyógyászatban a legtöbb európai országban és Amerikában széles körben használják nyugtatóként (Houghton és Seth, 2003). A benzodiazepin gyógyszerek szerkezete egy benzolgyűrűből áll, amely egy hét tagú heterociklusos egységet tartalmazó diazepin rendszerhez fuzionált, a gyűrű 1. és 2. pozíciójában két nitrogénatommal. A P. incarnatából izolált indol-alkaloidok, nevezetesen a harman, harmol, harmin, harmalol és harmalin egy öt tagú, egy nitrogénatomot tartalmazó heterociklushoz fuzionált benzolgyűrűből állnak.
Sok tanulmány jelezte, hogy a P. incarnata farmakológiai profilja hasonló a benzodiazepinekhez, és a gamma-aminovajsav (GABA) receptorokon keresztül hat (Jawna-Zboiñska et al., 2016). A M. speciosa leveleit hagyományos gyógyszerként hasmenés, cukorbetegség kezelésére és a vérkeringés javítására használták (Vicknasingam et al., 2010). A mitragynin a M. speciosa-ban jelen lévő fő indol-alkaloid, analógjaival, a speciogyninnel, a paynantheinnel és a speciociliatinnal együtt (León et al., 2009). A M. speciosa vizes kivonatával és alkaloidális kivonatával végzett két vizsgálat antidepresszáns-szerű hatást váltott ki a viselkedési kétségbeesés egérmodelljeiben (Kumarnsit et al., 2007). Az Idayu és munkatársai (2011) által a mitragyninnel végzett vizsgálat a depresszió állati viselkedési modelljében a hipotalamusz-hipofízis-mellékvese (HPA) tengellyel való kölcsönhatáson keresztül a neuroendokrin rendszerben antidepresszáns hatást mutat (Idayu és munkatársai, 2011).
A Piper methysticum G. Forst-ot kava nevű italként fogyasztják, amely kellemes mentális állapotot idéz elő a vidámság érzése felé, miközben csökkenti a fáradtságot és a szorongást (Bilia és munkatársai, 2002). A vizsgálat azt mutatja, hogy a legtöbb farmakológiai aktivitást a lipidoldékony kivonat megtartja a vizes kivonathoz képest. A lipidben oldódó kivonat legalább hét piront tartalmaz, amelyek kavalakton néven ismertek. A kavalaktonok általában kölcsönhatásba lépnek a dopaminerg, szerotonin, gamma-aminovajsav (GABA), glutamaterg neurotranszmisszióval, megakadályozzák a monoamino-oxidáz B (MOB) működését, és különféle hatásokat gyakorolnak az ioncsatornákra is (Grunze és mtsai., 2001). A dihidrometiszticin a kava növényben található hat fő kavalakton egyike. A dihidrometiszticin szerkezete egy aril-etilén-α-pironból áll, amely egy indolszerű részhez kapcsolódik, amely nitrogének helyett két oxigént tartalmaz. Hozzájárul az anxiolitikus hatáshoz és antidepresszáns drogként hat. Kettős vak, placebo-kontrollált vizsgálatok kimutatták, hogy a kavalaktonok szorongásoldó hatást fejtenek ki a mentális és motoros funkciók depressziója nélkül, és javítják az alvás minőségét. A kavalaktonok alternatívát jelentenek a benzodiazepinek használatának kiváltására a depresszió terápiájában (Malsch és Kieser, 2001).
A valeriana officinalis L., más néven valeriana széles körben használt nyugtató, görcsoldó, hipnotikus hatású és anxiolitikus hatású szer (Ghaderi és Jafari, 2014). A valerénsav és a valepotriátok hatóanyagként szerepelnek a gyógyszerkészítményekben, és a valeriána kereskedelmi nyers kivonatait számos országban regisztrálták (Bos és mtsai., 2002). A valepotriátokat, amelyek polihidroxiciklopenta-(c)-piránok triésztereit tartalmazzák a következő karbonsavakkal: ecetsav, valerinsav, izovalerián, α-izovaleroxi-izovalerinsav, β-metilvalerinsav, β-acetoxi-izovalerinsav, β-hidroxi-izovalerinsav és β-acetoxi-β-metilvalerinsav, nyugtatóként használják. A valepotriátok instabilak, termolabilisak és savas vagy lúgos körülmények között vízben, valamint alkoholos oldatokban gyorsan bomlanak (Bos és mtsai., 2002). A valepotriátok hasznosak az állatok és az emberek állapotának javításában a benzodiazepin megvonás során (Poyares et al., 2002).
Noha számos különböző kémiai összetevője van, a hatásmechanizmusról úgy számoltak be, hogy a valeriána kölcsönhatásba lép az agy GABA-rendszerével a GABA-transzamináz gátlásán, a GABA-receptorral/benzodiazepinnel való kölcsönhatáson és a GABA szinaptoszómákban történő felvételének és bevitelének zavarásán keresztül (Sichardt et al., 2007). Különböző modelleket használtak a növények antidepresszáns hatásainak vizsgálatára. A farmakodinamikai modellek között in vitro, in vivo és klinikai modelleket használtak a hatások értékelésére (1. táblázat). Az áttekintett kiválasztott növényfajok többségét in vivo szinten vizsgálták, néhányat in vitro tanulmányoztak, és csak a kava esetében végeztek klinikai vizsgálatokat. Minden esetben további kutatásokat kell végezni a hatóanyagok, a leghatékonyabb dózis megállapítására, valamint annak meghatározására, hogy ez változik-e a különböző típusú depressziók között.

TABLE 1. TÁBLA. Az áttekintett növények farmakológiai vizsgálatainak információi.
Indol-alkaloidok
Az indol-alkaloidok biciklikus szerkezetűek, egy hattagú benzolgyűrűből állnak, amely egy öttagú nitrogéntartalmú pirrolgyűrűhöz fuzionált. Ez a nitrogénatomos pirrolgyűrű adja az indol-alkaloidok alapvető tulajdonságait, amelyek különösen farmakológiailag aktívvá teszik őket (El-Sayed és Verpoorte, 2007). Az indol-alkaloidok széles körben elterjedtek az Apocynaceae, Loganiaceae, Rubiaceae és Nyssaceae családokba tartozó növényekben. A növényekből izolált fontos indol-alkaloidok közé tartozik a vérnyomáscsökkentő gyógyszer, a Rauvolfia serpentina-ból származó reserpin (Sagi és mtsai., 2016) és a Catharanthus roseusból származó erős daganatellenes gyógyszerek, a vinblastin és a vinkristin (El-Sayed és Verpoorte, 2007). Az indol-alkaloidok hatékonyságával kapcsolatos vizsgálatok a depresszió kezelésében nem új keletűek, és már 1952 óta folynak, de jelenleg nagyon kevés figyelmet fordít a tudományos közösség az antidepresszáns tulajdonságokkal felruházott növények terápiás hasznosságának előnyeire.
Az indol-alkaloidokat gyakran a G-fehérje receptorok működésével hozzák kapcsolatba, különösen a szerotonin (5-HT/hidroxitriptamin) receptorokon keresztül történő neuronális jelátvitelhez. A szabad N-H-n keresztüli hidrogéndonor mellett a π-elektronsűrűség jelenléte hozzájárul a planáris indolváz legmagasabb elfoglalt molekuláris orbitálisának (HOMO) energiájához. Ez lehetővé teszi a nukleobázisokkal, különösen a protonált atomokkal, valamint a célfehérjékkel való kölcsönhatást (de Sa és mtsai., 2009). A neurotranszmitter szerotonin kémiai szerkezete elektronokban gazdag aromás indolgyűrűn alapul. A nitrogénatom jelenléte az indolgyűrűben az aromás rendszer fenntartását szolgálja, és inkább savassá teszi a kötődést N-H, mint bázissá a nitrogént. Az indolgyűrű az N-H részen keresztül hidrogénkötéseket, az aromás részen keresztül pedig π-π stacking vagy kation-π kölcsönhatásokat képes kialakítani (Shimazaki és mtsai., 2009). Az indolgyűrűk hidrofobicitása közel azonos a fenil alegységével, és kevésbé hidrofób, mint a klasszikus izoszteres benzotiofén és benzofurán gyűrű. Az N-H indolcsoport döntő szerepet játszik a célzott bioreceptorral való kölcsönhatásban, míg a szintetizált benzotiofén- és benzofurán-származékok mérsékelt vagy korlátozott affinitást mutatnak a célzott bioreceptorral szemben (de Sa és mtsai., 2009). A rezerpin az elmúlt 60 év során izolált indol-alkaloidok egyike, amelyek szedatív hatást mutatnak a központi idegrendszerre. Egyébként két, az agyban található vegyi anyag, nevezetesen a triptamin és a szerotonin szintén indol-alkaloid-származékok.
Az antidepresszáns hatásért felelős növényi kivonatokból származó aktív összetevők jelenleg még mindig nem tisztázottak. Ezért megpróbálunk azonosítani néhány fontos, antidepresszáns hatást mutató növényi kivonatokból izolált kémiai szerkezetet, és megállapítani a vázszerkezeti hasonlóságot, amely hozzájárulhat az antidepresszáns hatáshoz. Korai kísérletek történtek a szerotonin és az indol-alkaloidok közötti szerkezeti hasonlóságok azonosítására. A legmarkánsabb hasonlóságot az öttagú gyűrűkkel fuzionált hattagú heterociklusos gyűrűk alkotják. A különbség a nitrogénatom jelenléte vagy a π elektronok eloszlása (1. ábra). Egy szerkezet-aktivitás kapcsolat vizsgálaton keresztül Nichols (2012) arról számolt be, hogy a különböző típusú molekulák aktivitásának változása arra utal, hogy a receptor nagyon érzékeny a triptamin jellegére. Az antidepresszáns növényekből sikeresen izolált egyéb kémiai vegyületeket azért említjük ebben az áttekintő tanulmányban, mert ezek talán specifikus agonisták bizonyos szubsztitúciós mintákkal, amelyek képesek szelektíven aktiválni az effektorok egy alcsoportját. Ezt a jelenséget ma funkcionális szelektivitásként ismerjük.
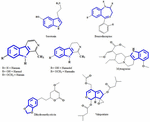
1. ÁBRA. Szerotonin, benzodiazepin és antidepresszáns növényekből izolált vegyületek kémiai szerkezete. Hasonlóság a vázszerkezetben, amely hat tagú heterociklusos gyűrűkből áll, amelyekhez öt tagú gyűrűk kapcsolódnak.
A szerotonin, mint endogén receptor agonista széles körben használatos az agyműködésben és a megismerésben (Fink és Göthert, 2007). A szerotonin hét receptorcsaládon (5-HT1-5-HT7) keresztül fejti ki funkcióit, amelyek a G-fehérje kapcsolt receptorcsalád tagjai. Számos indol-részt hordozó vegyületről írták le, hogy affinitással rendelkeznek a különböző szerotoninreceptorok felé (Kochanowska-Karamyan és Hamann, 2010). Az indol-alkaloidok (exogén agonisták) szerkezeti hasonlósága az endogén neurotranszmitterekkel, például a szerotoninnal, arra késztette a kutatókat, hogy megjósolják e molekulák potenciális neurológiai aktivitását. Az exogén agonisták neurotranszmissziójával kapcsolatos folyamatok sematikus ábrája a 2. ábrán látható.
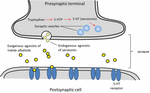
2. ÁBRA. A neurotranszmisszióhoz kapcsolódó folyamatok vázlata. Exogén agonisták a növényekből származó indol-alkaloidok, amelyek a szerotoninhoz hasonló szerkezetűek, ami lehetővé teszi számukra, hogy a szerotoninreceptorokba (5-HT-receptorokba) kötődjenek.
Az indolgyűrű bioizoszterként is ismert, és hasonló kémiai és fizikai tulajdonságokkal rendelkezik, mint a biológiai molekulák. Ezt a hasonlóságot használják a prototípus gyógyszer kifejlesztése során, amelynek célja a farmakológiai aktivitás javítása és a farmakokinetikai profil optimalizálása. Egy másik tanulmányban a benzofuránok és a tienopirrol farmakológiai értékelése olyan bioizoszter molekulákhoz vezetett, amelyek dimetiltriptamin-szerű aktivitással rendelkeznek. A benzotiofénekkel és 3-indenalkilaminokkal végzett korai munka azt mutatta, hogy a gyűrűs szubsztituenseket nem tartalmazó vegyületek esetében a patkány fundusban agonistaként való viselkedés képessége nagyjából megegyezik a triptaminokéval. Az eredmények azt mutatták, hogy az indol NH nem elengedhetetlen az 5-HT2 receptor aktiválásához a patkány fundusban (Nichols, 2012). A 2-aril indol NK1 receptor antagonisták és származékaik sorozata jó ligandumok, de alacsony orális biológiai hozzáférhetőséggel rendelkeznek patkányokban. Az oldhatóság és a felszívódás növelése érdekében a bázikus nitrogént bevezették, ami az azaindol analóg és rokon vegyületekhez vezetett, amelyek a 2-aril indol NK1 receptor antagonisták sorozatával azonos NK1-kötési affinitást mutatnak (Cooper és mtsai., 2001). 2 fenilindol-származék ligandumok molekuláris dokkolása szerotonin 5-HT6 és melanokortin-4 receptorokkal azt jelzi, hogy a kiváltságos állványzat a természet konzervált alzsebétől és a nem konzervált kötőzsebektől függően alkalmazkodhat. A kötőzseb nem konzervált részeinek kölcsönhatásai felelősek a megfelelő célreceptor általi molekuláris felismerés fontos különbségeiért (Bondensgaard et al., 2004).
De Sa és munkatársai (2009) szerint a természetes forrásokban található gyakori indol-alkaloidok a triptofán aminosavak az emberi táplálkozásban és a terápiás hatású növényi hormonok felfedezése, például gyulladáscsökkentő, foszfodiészteráz-gátló, 5-HT receptor agonista és antagonista, kannabinoid receptor agonista és HMG-CoA reduktáz gátló. Az indol-állványzat kötőzsebekkel rendelkezik, és közös komplementer kötődománnal rendelkezik a célreceptorral, amely a GPCR-ek (G-protein fontos membránreceptorok kapcsolt) osztályába tartozik. A legtöbb forgalomban lévő gyógyszer az indol szubstruktúrát tartalmazza. Ezek közé tartozik az indometacin, az ergotamin, a frovatriptán, az ondansetron és a tadalafil.
Következtetés
Ez az áttekintés megállapította, hogy a pszichiátriai betegségek kezelésére javallott növényi alapú gyógymódok többsége nyers vagy félig tisztított. Az in vivo és in vitro eredmények eltérőek és nem voltak reprodukálhatók, mivel a különböző biogeográfiai régiókban a növények másodlagos metabolit tartalma korrelál a tápanyagok elérhetőségével, az éghajlati és ökológiai feltételekkel. Ezenkívül a növények bioaktivitásához egyetlen vegyület vagy vegyületek keveréke is hozzájárulhat. A szerzők azt javasolják, hogy a növényi alapú gyógyszerek jobb jellemzése érdekében in vitro és in vivo vizsgálatokkal kell végezni a hatóanyagok megszerzésére irányuló erőfeszítéseket, a fitokémiai anyagok azonosítását és a metabolomikai vizsgálatokat. A legtöbb esetben az indol-alkaloidok szintézisét a természetben előforduló molekulák és a szerotoninhoz való hasonlóságuk inspirálta.
A növényi forrásokból származó indol-alkaloidok a szintetikushoz képest meglehetősen összetettek. A szintetikus indol-alkaloidok jelentősége már megalapozott, mivel a szerkezet különböző ligand receptorok, enzimgátlók és modulátorok bioreceptorok. A természetben előforduló indol-alkaloidok némelyike a jelenleg ismert módszerekkel nem szintetizálható. Ezenkívül az indol-alkaloidok hatékonyságára vonatkozó legtöbb információt szintetikus indol-alkaloidokról jelentették. Ennek eredményeként számos, a természetben előforduló indol-alkaloidban rejlő potenciál, mint a különböző pszichiátriai rendellenességek új gyógyszerei, még mindig kiaknázatlan. Történelmileg a növényi eredetű vegyületek voltak a forrása számos, az orvostudományban használt, legsikeresebb hatóanyag-vezetéknek vagy gyógyszernek. Ez azt jelzi, hogy még több felfedezésre várhat.
Összefoglalva, számos indol-alkaloidot alkalmaztak már antidepresszánsként vagy szolgáltatnak vezető struktúrákat annak fejlesztéséhez. Eredményeink alapján a növények olyan indol-alkaloidok tárházát tartalmazzák, amelyek értékes kiindulópontot jelentenek a jövőbeli antidepresszánsok kifejlesztéséhez.
Author Contributions
HH: Kézirat előkészítése. MY: Az angol nyelv szerkesztése és néhány fontos információ javasolása a kézirat javítása érdekében. AR: Hozzájárulás a neurotranszmisszióval kapcsolatos folyamatok vázlatának megértéséhez.
Finanszírozás
A munka támogatását az Universiti Malaysia Pahang biztosította az UMP RDU170302 kutatási támogatáson keresztül HH számára.
Érdekütközéssel kapcsolatos nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Bilia, A. R., Gallori, S. és Vincieri, F. F. (2002). Kava-kava és szorongás: növekvő ismeretek a hatékonyságról és biztonságosságról. Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., and Rodrigues, A. L. S. (2009). Az aszkorbinsav adagolása antidepresszáns-szerű hatást vált ki: bizonyíték a monoaminerg neurotranszmisszió részvételére. Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., and Bywater, R. P. (2004). Kiváltságos struktúrák felismerése G-fehérje kapcsolt receptorok által. J. Med. Chem. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., and Pras, N. (2002). A valepotriátok meghatározása. J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., and Yunes, R. A. (2000). Természetben előforduló antinociceptív anyagok növényekből. Phytother. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). A növények és a központi idegrendszer. Pharmacol. Biochem. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl indol NK 1 receptor antagonisták: az indol szubsztitúció optimalizálása. Bioorg. Med. Chem. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., and Alberto, C. (2009). A természettől a gyógyszerkutatásig: az indolváz mint “kiváltságos szerkezet”. Mini Rev. Med. Chem. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., and Verpoorte, R. (2007). Catharanthus terpenoid indol alkaloidok: bioszintézis és szabályozás. Phytochem. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., and Costa, E. A. (2016). A szorongás és a depresszió kezelése: gyógynövények visszatekintésben. Fundam. Clin. Pharmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., and Weiss, G. (2011). Farmakológiai vizsgálatok az orbáncfű (Hypericum perforatum) és a golgotavirág (Passiflora incarnata) növényi gyógyszerkombinációján: in vitro és in vivo bizonyítékok a Hypericum és a Passiflora közötti szinergiára antidepresszáns farmakológiai modellekben. Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., and Göthert, M. (2007). A neurotranszmitter felszabadulás 5-HT receptoros szabályozása. Pharmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., and Jafari, M. (2014). Hatékony növényregeneráció, genetikai hűség és két gyógyászati vegyület magas szintű felhalmozódása a Valeriana officinalis L. S. Afr. regenerált növényeiben. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., and Walden, J. (2001). A kava-pironok az ismert hangulatstabilizátorokhoz hasonló hatást gyakorolnak a neuronális transzmisszióra és a transzmembrán kationáramokra – egy áttekintés. Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., and Liu, B.-Y. (2016). A flavonoidok és a kapcsolódó analógok antidepresszáns-szerű hatásai és mechanizmusai. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., and Winterhoff, H. (2008). A Valeriana officinalis L. sl kivonatai anxiolitikus és antidepresszáns hatást mutatnak, de sem szedatív, sem myorelaxáns tulajdonságokkal nem rendelkeznek. Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., and Seth, P. (2003). Növények és a központi idegrendszer. Pharmacol. Biochem. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. (2011). A Mitragyna speciosa Korth-ból izolált mitragynin antidepresszáns-szerű hatása a depresszió egérmodelljében. Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). A Passiflora incarnata L. javítja a térbeli memóriát, csökkenti a stresszt és befolyásolja a neurotranszmissziót patkányokban. Phytother. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., and Hamann, M. T. (2010). Tengeri indol-alkaloidok: potenciális új gyógyszernyomok a depresszió és a szorongás kezelésére. Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., and Intasaro, P. (2007). Fos-szerű immunreaktivitás patkány dorzális raphe magokban, amelyet a Mitragyna speciosa alkaloid kivonata indukál. Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., and Cutler, S. J. (2009). Az USA-ban termesztett Mitragyna speciosa leveleinek fitokémiai jellemzése. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., and Kieser, M. (2001). A kava-kava hatékonysága a nem pszichotikus szorongás kezelésében, benzodiazepinnel történő előkezelést követően. Psychopharmacology 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., and Dijk, D.-J. (2016). REM alvás homeosztázis REM alvás hiányában: Az antidepresszánsok hatása. Neuropharmacology 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., and Kothiyal, P. (2015). A tengeri bioanyagok depressziója és szerepe: áttekintés. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). A szerotonin 5-HT 2A agonisták szerkezet-aktivitás összefüggései. WIREs Membr. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organization, W. H. (2017). Depresszió adatlap 2016. Elérhető az alábbi címen: http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., and Tufik, S. (2002). Javíthatja-e a valeriána az álmatlanságban szenvedők alvását benzodiazepin megvonás után? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., and Khan, I. A. (2016). A Rauwolfia serpentina gyökereiből származó alkaloidok mennyiségi meghatározása és jellemzése ultranagy teljesítményű folyadékkromatográfia-fotodiódasoros tömegspektrometria segítségével. Anal. Bioanal. Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., and Deed, G. (2009). A Kava Anxiety Depression Spectrum Study (KADSS): randomizált, placebo-kontrollált crossover vizsgálat a Piper methysticum vizes kivonatával. Psychopharmacology 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., and Yamauchi, O. (2009). Indolgyűrűket tartalmazó fémkomplexek: szerkezetek és a fém-indol kölcsönhatások hatásai. Coord. Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., and Nieber, K. (2007). Patkány agykérgi neuronok posztszinaptikus potenciáljainak modulációja különböző alkoholokkal macerált valeriánakivonatokkal: az adenozin A1- és GABAA-receptorok részvétele. Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). A ketum (Mitragyna speciosa) nem hivatalos használata opioidmegvonásra a félszigetszerű Malajzia északi államaiban és a droghelyettesítő terápia következményei. Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., and Naidu, M. (2016). A Mitragyna speciosa levélkivonat antipszichotikum-szerű hatást mutat, amely képes enyhíteni a pszichózis pozitív és negatív tüneteit egerekben. Front. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., and Kong, L.-D. (2008). A citrusfélékhez kapcsolódó apigenin nevű vegyi anyag antidepresszáns jellegű viselkedési és neurokémiai hatásai. Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar