1. Permeabilitás
2. Fluiditás
3. Heterogenitás
– Belső
– Külső
– Hajlás, vastagság
A sejtmembránok funkcióit molekuláris összetételük határozza meg. E molekulák típusa és aránya határozza meg a membránok fizikai-kémiai jellemzőit: féláteresztő képesség, aszimmetria, fluiditás, javítás és újrahasznosítás.
Áteresztő képesség
A membránok féláteresztő képessége a membránok belső hidrofób környezetének következménye, amelyet a lipidzsírsavláncok hoznak létre, és amelyen az elektromos töltéssel rendelkező molekulák nehezen tudnak áthatolni. Így a molekulák szabad diffúziójának megakadályozásával a membránok olyan kompartmenteket képezhetnek, amelyek elkülönült belső és külső környezetet tartanak fenn. A permeabilitás azonban szelektív. A polaritás és a méret a fontosabb molekuláris jellemzők, amelyek befolyásolják a membránokon való átjutás képességét. Az elektromos töltés nélküli kis molekulák, mint például a CO2, N2, O2, és a zsírban jól oldódó molekulák, mint például az etanol, passzív diffúzióval szinte szabadon átjuthatnak a membránokon (1. ábra). Az elektromos töltéssel rendelkező molekulák áteresztőképessége alacsonyabb, amikor a pozitív töltések száma megegyezik a negatív töltések számával, ezek az úgynevezett töltés nélküli molekulák, mint például a víz és a glicerin. Azt gondolhatnánk, hogy a víz szabadon áthaladhat a membránokon, de vannak bizonyos korlátozások, és ezért egyes membránok tartalmaznak aquaporinokat, egyfajta transzmembrán fehérjét, amely egy csatornával rendelkezik, és lehetővé teszi a víz szabad áthaladását. A nagy, töltés nélküli molekulák, például a glükóz, kevéssé képesek áthaladni a membránokon. A membránok az ionok és a töltött molekulák számára nagymértékben átjárhatatlanok. A passzív diffúzióval történő áteresztőképességi együttható néhány értéke: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glicerin: 10 -6 cm/s, nátrium és kálium: 10 -14 cm/s.
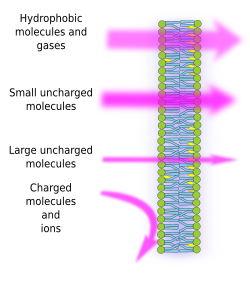
Az ionok és molekulák egyenlőtlen eloszlása a membrán két oldala között lehetővé teszi elektrokémiai gradiensek létrehozását és fenntartását. Az elektromos töltések belső és külső koncentrációja közötti különbséget nevezzük membránpotenciálnak. Ez a gradiens számos sejtfunkcióhoz, például az ATP-szintézishez és az információk idegek mentén történő továbbításához szükséges. A szemipermeabilitás felelős az ozmotikus folyamatokért is, amelyek a víz mozgását jelentik a membránokon keresztül az egyik oldalon lévő kevésbé koncentrált oldatból a másik oldalon lévő koncentráltabb oldatba, hogy mindkét koncentráció kiegyenlítődjön. Ily módon a növényi sejtek egyes oldott anyagok magasabb intracelluláris koncentrációjának köszönhetően képesek növekedni, amelyek hatására víz kerül a sejtbe, ami viszont belső hidrosztatikus nyomást (úgynevezett turgornyomást) eredményez, amely a sejtfalakat kifelé nyomja. A membránokon nem szabadon áthaladó molekulák azért hasznosak a sejtek számára, mert gradienseket hozhatnak létre, amelyek információs mechanizmusként vagy energiatárolóként működhetnek. A sejtek rendelkeznek transzmembránfehérjékkel, amelyek lehetővé teszik a membránon való átjutást, illetve a töltött molekulák és ionok mozgását a sejtmembránok két oldala között, elkerülve a belső membrán hidrofób környezetét. Az izomösszehúzódást például olyan csatornák megnyílása váltja ki, amelyek csökkentik a meglévő iongradienst.
A szemipermeabilitást a membránok lipidösszetétele befolyásolja. Például a koleszterintartalom fontos a plazmamembránban. A koleszterintartalom növekedése csökkenti a fluiditást és növeli a hidrofobicitást, mindkét tulajdonság a membránt átjárhatatlanabbá teszi. Így a koleszterin 30 % fölé emelkedése (ami magas érték) a mielinmembránokat nagyon alkalmassá teszi az axonok szigetelésére és az akciós potenciál axon mentén történő terjedésének optimalizálására.
Folyékonyság és laterális tartományok
A folyékonyság a membránok tulajdonsága. A molekuláknak a membránok belsejében való mozgási képességével függ össze. A nagyobb fluiditás azt jelenti, hogy a mozgások gyakoribbak. A sejtmembránok tulajdonképpen egy zsírlap, ahol a molekulák félig folyékony, viszkózus állapotban vannak. Így sejthető, hogy a molekulák diffúzióval tudnak mozogni. Például egy glicerin-foszfolipid, amely a plazmamembrán külső monorétegében található, kétféle mozgást végezhet: laterális, azaz ugyanazon a monorétegen belüli, és flip-flop, azaz egyik monorétegből a másikba ugrás (2. ábra). Mesterséges membránokban ezt a kétféle mozgást figyelték meg, a laterális mozgások sokkal gyakoribbak, mint a flip-flop. Oldalirányú diffúzióval a lipidek 20 másodperc alatt 30 µm-t is képesek megtenni; egy közepes méretű sejt teljes kerületét egy perc alatt képesek bejárni. A flip-flop mozgások azonban valóban ritkák, mert a lipidmolekula hidrofil fejének át kell kelnie a zsírsavláncok belső rétegén, és ez termodinamikailag nehéz. Egy lipidmolekula esetében a flip-flop elmozdulás valószínűsége havonta körülbelül egy alkalom. A koleszterin azonban másképp viselkedik, és meglehetősen könnyen képes flip-flopot végezni.

A membrán fluiditása a kémiai összetételtől függően változhat. Általában a rövidebb zsírsavláncok és a zsírsavak szénatomjai közötti telítetlen kötések nagyobb mennyisége növeli a membrán fluiditását. A koleszterin mennyisége szintén befolyásolja a membrán fluiditását, de a nettó hatás a hőmérséklettől és a membránban lévő lipidek típusától függ. A koleszterinnek két hatása van: gátolja a szilárd gélállapotba való átmenetet (kisebb fluiditás), de csökkenti a telítetlen zsírsavláncok rugalmasságát is. Általánosságban elmondható, hogy a koleszterin koncentrációjának növekedése csökkenti a membrán fluiditását, bár alacsony hőmérsékleten a hatás éppen ellentétes. A sejt belső membránjai, például az endoplazmatikus retikulum membránjai nagyon kevés koleszterint tartalmaznak, ezért folyékonyabbak. Ezenkívül a koleszterin a membránoknak egy másik, hidrofóbitásnak nevezett tulajdonságot biztosít, amely a membránokat átjárhatatlanabbá teszi.
A membrán két monorétege közötti eltérő molekuláris összetétel, az úgynevezett membrán aszimmetria, az egyes monorétegekben eltérő fluiditást hozhat létre. A molekuláris összetételtől függően a lipidek két fizikai fázisban lehetnek: folyadékrendezett (kisebb fluiditású) és folyadékrendezetlen (nagyobb fluiditású). A plazmamembrán külső monorétege feltételezhetően gyakrabban van a folyadékrendezett fázisban, míg a belső monoréteg hajlamos a folyadékrendezetlen fázisban lenni.
A sejtek kémiai összetételük megváltoztatásával módosíthatják a membránok fluiditását. A baktériumok például beállítják a zsírsavláncok telítettségét és hosszát, így a membrán fluiditása a környezeti feltételekhez igazítható. A glicerofoszfolipidek, például a foszfatidil-etanolamin koncentrációjának változása szintén módosíthatja a fluiditást. Egyes rovarok nem képesek szterolokat, például koleszterint szintetizálni, és membránjaik szteroljai a táplálékból származnak. A sejtmembránjaik fluiditását a foszfatidil-etanolamin különböző koncentrációival változtatják.
A mitokondriumok belső membránjának erős, áthatolhatatlan gátnak kell lennie a protongradiens létrehozásához és fenntartásához. Ezt a koleszterintartalom növelésével lehetne elérni. Így a hidrofóbia nagyobb lesz, viszont a koleszterin viszont csökkenti a fluiditást, ami nagyon fontosnak tűnik a fehérjék működése szempontjából ebben a membránban. A mitokondriumok a problémát kardiolipinnel oldják meg, egy telítetlen foszfolipiddel, amely növeli a hidrofobicitást, de nem csökkenti jelentősen a membrán fluiditását.
3. Heterogenitás
A fluiditás miatt azt gondolhatjuk, hogy a fehérjék véletlenszerűen oszlanak el, ezért a membránok molekuláris összetételüket tekintve homogének, azaz a membrán régiótól függetlenül azonos molekuláris tartalmat és arányt mutatnak. Ez azonban nem igaz. A molekulák laterális diffúziójának vannak olyan korlátai, amelyek a membránok heterogenitását okozzák, ami azt jelenti, hogy a membránnak vannak különböző molekuláris összetételű régiói. A nem polarizált sejtekben és 200 nm-nél nagyobb léptékben a plazmamembrán homogénnek tűnik, de 200 nm alatti léptékben heterogén. A membránok mikrodomainjei feltehetően 60 µm körüli méretűek. A lipidek és fehérjék néhány milliszekundum alatt többnyire 60-200 nm-es területekre korlátozódó oldalirányú mozgást mutatnak, majd átugranak egy másik szomszédos területre, ahol újabb rövid ideig ott maradnak. Ezt a viselkedést nevezzük sós diffúziónak.
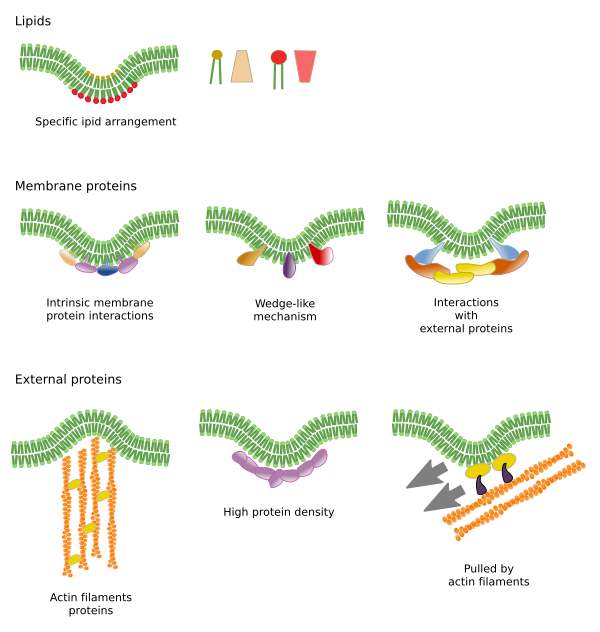
A molekulák laterális mozgásának korlátozását több mechanizmus is okozhatja: kölcsönhatások a citoszkelettel vagy az extracelluláris mátrixszal, a membránmolekulák egymás közötti kölcsönhatásai, a helyi membránterületek eltérő sűrűsége (a fluiditás változása), az elektromos töltések mennyisége, a membrán görbülete és a membrándomének eltérő vastagsága (3. ábra).
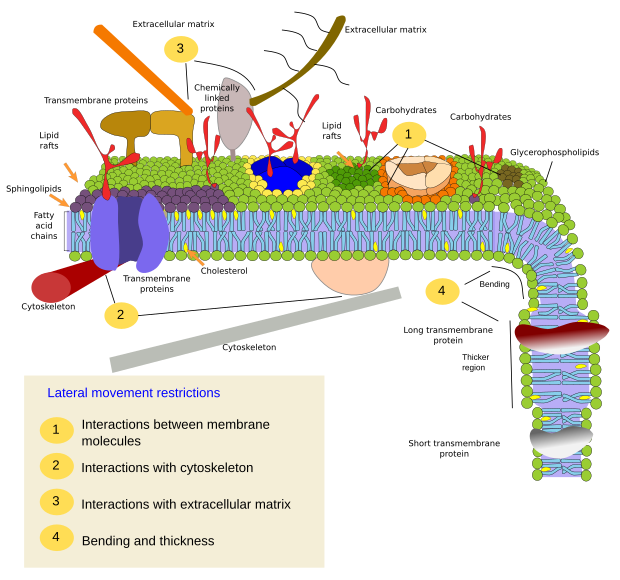
Belső kölcsönhatások
A membránmolekulák egymás közötti kölcsönhatásai korlátozzák a laterális mozgást. Mind a fehérjék, mind a lipidek mozgását befolyásolják ezek a kölcsönhatások, amelyek eltérő molekuláris összetételű mikrodomének kialakulásához vezetnek (4. ábra). Az eredmény a molekulák laterális heterogén eloszlása a membránokban. A molekuláris arányoktól függően a lipid mikrodomének különböző sűrűségűek (azaz fluiditásúak) lehetnek: szilárd, folyékony rendezett és folyékony rendezetlen. A leggyakoribb sűrűség a folyékony rendezetlen, amely a legfolyékonyabb.
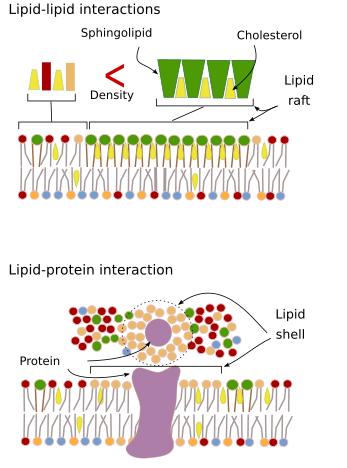
A szfingolipidek és a koleszterin spontán módon társulhatnak egymás között, csökkentve a mozgékonyságukat és növelve a molekulasűrűséget a szomszédos területekhez képest. Egy kis elkülönülő molekulacsoport alakul ki, mint egy tutaj a lipidek tengerében. Valójában ezeket a molekuláris társulásokat lipid tutajoknak nevezik, és úgy gondolják, hogy nagyon gyakoriak és a sejtmembránokban. A lipidtutajok rendkívül dinamikus viselkedést mutatnak, mozoghatnak, növekedhetnek, csökkenhetnek, megjelenhetnek és eltűnhetnek. A membránok valóban sok sűrű doménből állnak, amelyek oldalirányban haladnak a glicerofoszfolipidek között, így a membránok molekuláris eloszlásukat tekintve meglehetősen heterogének. Egyes kísérletek arra utalnak, hogy bizonyos típusú fehérjék jobban “érzik” magukat a lipidtutajok belsejében. Ezek a fehérjék több időt töltenek a lipidtutajokon belül, mint kívül, így egy ideig ezeken a sűrűségeken belül utaznak. Ez a molekulák szegregációját okozza a membrán mentén, és növeli annak valószínűségét, hogy a különböző molekulák több időt töltenek egymás közelében, mint véletlenül (diffúzió), növelve ily módon bizonyos molekuláris reakciók valószínűségét. Továbbá feltételezhető, hogy bizonyos típusú lipidek magas koncentrációja a lipidtutajokban olyan sajátos kémiai környezetet hoz létre, amely megkönnyíti bizonyos kémiai reakciókat vagy molekuláris kölcsönhatásokat. A lipidtutajok jelenlétét a plazmamembrán külső monorétegében javasolták, mivel ezen az oldalon a szfingolipidek nagy mennyiségben fordulnak elő. Feltételezések szerint a membrándomének az organellumok membránjaiban is léteznek, és úgy gondolják, hogy egyes funkcióik ezekre a membrándoménekre támaszkodnak.
A plazmamembrán belső monorétegében a mikrodomének a fehérjék bázikus citoszolikus doménjei vagy kétértékű kationdoménjei és a lipidek negatív poláris fejei közötti elektrosztatikus kölcsönhatások révén jönnek létre. Egy másik, kevésbé ismert példa a foszfatidil-inozitol-biszfoszfát és a koleszterin közötti társulás, amely ebben a monorétegben mikrodoméneket képez. Ezek a citoszol felé néző mikrodomének befolyásolhatják az intracelluláris fehérjeállványzatokat.
Hagyományosan úgy gondolták, hogy a két membránmonoréteg között nincsenek kölcsönhatások, és egymástól függetlenül osztják el mikrodomainjeiket. A bizonyítékok azonban arra utalnak, hogy vannak kölcsönhatások egymás között. A transzmembránfehérjék egyszerre hatnak mindkét monorétegre, mivel áthaladnak a teljes membránon. A két monoréteg közötti szinkronizáció másik módját a hosszú zsírsavláncok közvetíthetik, mint például egyes szfingolipidek, amelyek hossza 24 szénatomos is lehet (a normál hossz 18). Ezek a hosszú láncok beilleszkedhetnek a másik monoréteg lipidjeinek zsírsavláncai közé, és befolyásolhatják a lipideloszlást. Továbbá a hosszú zsírsavláncokkal rendelkező lipiddoméneket feltehetően ellensúlyozzák a másik monorétegben lévő rövid zsírsavláncú lipidmikrodomének, állandóan fenntartva a membrán vastagságát.
A membránfehérjék, mind az integrális, mind a társult, kölcsönhatásba léphetnek egymással is, és makromolekuláris vázakká állhatnak össze, hogy megkönnyítsék az információátvitelt, a sejt-sejt felismerést, egyes enzimatikus tevékenységek elindítását és a sejtek mozgását. Vannak olyan multimer fehérjék is, amelyek csak akkor aktívak, ha az összes alegység együtt van tartva. Az inzulinreceptor például négy alegységből áll. A fehérjék és a lipidek kölcsönhatásba léphetnek egymással membrándoméneket is alkotva. A belső monorétegben például a foszfatidil-inozitol elektromos kölcsönhatások révén társul a fehérjék köré, ami a lipidek poláris fejének foszfátjait módosítva szabályozható.
A külső elemekkel való kölcsönhatások
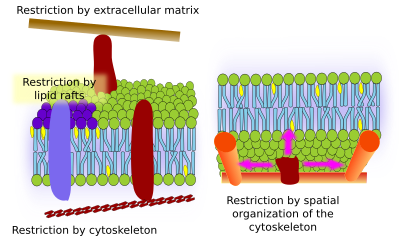
A belső membránfehérjéknek is lehetnek laterális mozgásaik, de ezek korlátozottabbak, mint a lipidek, főként az extracelluláris mátrixszal és a citoszkelettel való kölcsönhatások miatt az extracelluláris, illetve intracelluláris doménjeiken keresztül (5. ábra). Ezek a kölcsönhatások a diffúziónál hosszabb ideig tarthatják a fehérjéket a membrán kis területein. A citoszkeleton közvetlenül a plazmamembrán alatt kerítéseket képezhet, amelyek a fehérjéket kis területekre korlátozva tartják. Az aktin filamentumok és mikrotubulusok kis területeket zárhatnak körül, korlátozva a fehérjék és lipidek diffúzióját. A citoszkelettel való kölcsönhatások azért fontosak, mert ha a citoszkeleton kísérletileg dezorganizálódik, a membrán sokkal homogénebbé válik. A sejtek más mechanizmusokkal is rendelkeznek arra, hogy a fehérjéket meghatározott tartományokba korlátozzák. Például a bélhámsejtekben néhány transzporter és enzim az apikális plazmamembránban található, de a bazo-laterális doménben nem, mert a szoros kötések öve, egy molekuláris cipzár megakadályozza a diffúziót az apikális és bazo-laterális domének között. Az ilyen aszimmetrikus eloszlás elengedhetetlen a hámsejt fiziológiájához.
A membránhajlítás egy másik módja a mikrodomének létrehozásának. A membrángörbület kiindulópontja lehet egy vezikulum kialakításának, egy citoplazma kiterjesztésének a sejtek terjeszkedéséhez, egy organellum alakváltozásának vagy növekedésének, vagy egyszerűen csak egy gát elindításának a molekulák oldalirányú mozgásának korlátozására. Ez egy fizikai korlátozás a lipidek 3D-s elrendeződése által a membránredő kisebb szögében.
A membrán hajlításához szükséges molekuláris eszközök a membrán meghatározott régióiba rekrutálódnak. Ezek a mikrotartományok specifikus lipidösszetételűek vagy sajátos elektromos töltéskörnyezetűek lehetnek. A foszfoinozidok (PIP-ek), főként a PIP2 és PIP3, olyan lipidek, amelyek hozzájárulnak a membrán hajlításához szükséges fehérjék toborzásához. Hasznos molekulák, mert poláris fejük elektromos töltése és molekulaszerkezete kémiai reakciókkal könnyen módosítható. Ily módon egy adott membránterület tulajdonságai szükség esetén megváltozhatnak, és specifikus fehérjéket toborozhatnak. A foszfatidil-szerin is képes mikrodoméneket kezdeményezni a membránhajlításhoz, amikor a flipázok transzlokálják az egyik monorétegből a másikba.
Hajlítás és vastagság
A lipid mikrodomének olyan fehérjéket toboroznak, amelyek hatékonyan hajlítják a membránt. Vannak erre a szerepre specializált fehérjék (6. ábra). A BAR-doménes fehérjék (Bin/amphyphysin/Rsv161) ezek egyike. A hajlítást két mechanizmus indukálhatja: a membránt húzó vagy nyomó fehérjék íves állványzatának összeállítása, illetve a lipidek közé ékként beillesztett aminosav-szekvenciák. Például a caveolinok a membránok görbülését okozzák, hogy caveloákat képezzenek, a tetraspain a membránokat tubulusok kialakítására kényszeríti, az ESCRT az endoszómákon belüli vezikulaképződést segíti, hogy multivezikuláris testek alakuljanak ki. Az aktin erős membránhajlítást végez az aktin filamentum polimerizációja révén, amely a plazmamembránt kifelé tolja, ami a sejtek kitágulásához vezet. Számos fehérje, amely képes a plazmamembránt görbíteni, aktiválja az aktin polimerizációt is.
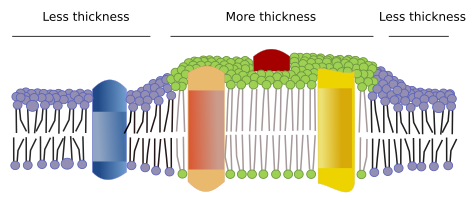
A membránokban más domének, fizikai domének is vannak, amelyeket molekulák, például transzmembránfehérjék alkotnak. Ezek a területek eltérő membránvastagságot mutatnak, mert hosszabb hidrofób aminosav-szekvenciájú fehérjéket tartalmaznak, amelyeket hosszabb zsírsavláncú lipidek vesznek körül (7. ábra). Ezek a fehérjék és lipidek jobban “érzik” magukat együtt, mivel hidrofób részeik megfelelően illeszkednek egymáshoz. Olyan membrándoméneket alkotnak, amelyek kizárnak más, rövidebb hidrofób régiókkal rendelkező molekulákat, akár fehérjéket, akár lipideket.
Bibliográfia
Honigmann A, Pralle A. (2016). A sejtmembrán kompartmentalizációja. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Membrángörbület a sejtbiológiában: a molekuláris mechanizmusok integrációja. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Magas koleszterinszint/alacsony koleszterinszint: hatások a biológiai membránokban: áttekintés Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.