L’immunomarquage utilise des anticorps pour détecter un antigène dans les cellules ou les tissus. Le principal avantage de l’immunomarquage en immunohistochimie (IHC) est la possibilité de voir la cible souhaitée dans un échantillon de tissu tout en conservant le contexte spatial et l’architecture du tissu.
Immunohistochimie (IHC) Coloration : Brève définition
Types de coloration
La coloration immunologique peut être réalisée directement ou indirectement. La conjugaison de nos anticorps validés par l’application à un certain nombre de fluorophores permet un marquage direct. Pour parcourir notre offre de conjugués directs, cliquez ici.
Souvent, sur la base des niveaux d’expression de l’antigène et de l’accessibilité, un conjugué direct n’est pas suffisant pour visualiser la cible d’intérêt. Dans ces cas, un marquage indirect est employé en utilisant un anticorps secondaire. La méthode préférée à la CST est d’utiliser des réactifs de détection très sensibles, en une étape, à base de polymères, spécifiques des IgG de lapin ou de souris.

Exemples de coloration IHC
Certains exemples de coloration IHC réalisés à la CST sont présentés ci-dessous. Chacun des anticorps utilisés ci-dessous a été soumis à notre processus de validation rigoureux afin d’évaluer en toute confiance la détection spécifique de l’antigène souhaité.
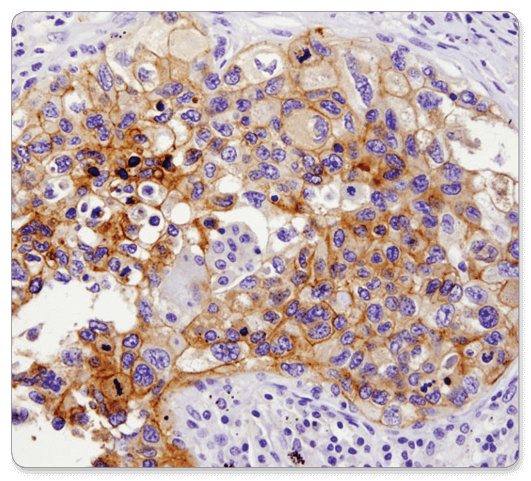
PD-L1 (E1L3N®) XP® Rabbit mAb #13684 : analyse IHC d’un carcinome pulmonaire humain inclus en paraffine en utilisant PD-L1 (E1L3N®) XP® Rabbit mAb.
PD-L1 (E1L3N®) mAb de lapin XP® #13684 : Analyse IHC de carcinome pulmonaire humain inclus en paraffine utilisant PD-L1 (E1L3N®) mAb de lapin XP®.
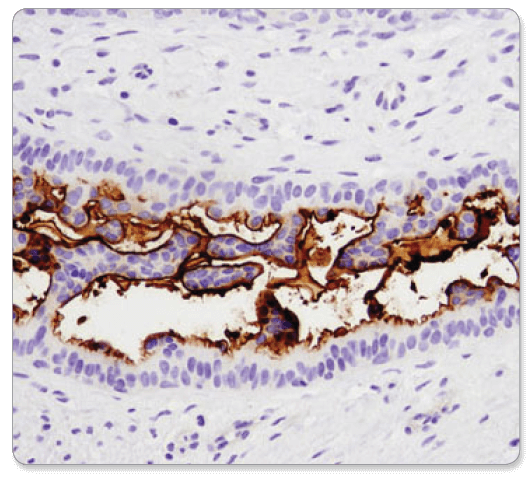
CD133 (D2V8Q) mAb de lapin XP® #64326 : Analyse IHC d’un carcinome mammaire humain inclus en paraffine utilisant l’anticorps de lapin CD133 (D2V8Q) XP®.
CD133 (D2V8Q) XP® Rabbit mAb #64326 : Analyse IHC d’un carcinome mammaire humain inclus en paraffine utilisant CD133 (D2V8Q) XP® Rabbit mAb.

α-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb #19245 : analyse IHC d’un carcinome endométrioïde humain inclus en paraffine utilisant α-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb réalisée sur le Leica® Bond™ Rx.
α-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb #19245 : analyse IHC d’un carcinome endométrioïde humain inclus en paraffine utilisant α-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb réalisée sur le Leica® Bond™ Rx.
Comment se fait la coloration par immunohistochimie (IHC) ?
Préparation des tissus
Les procédures de collecte, de conservation et de fixation des tissus varient selon l’échantillon ou la cible d’intérêt. La collecte et la fixation du tissu affectent directement l’intégrité de l’échantillon et vos résultats expérimentaux.
Les fixateurs de réticulation, comme le formol, sont souvent utilisés pour préparer les échantillons pour l’IHC car ils préservent l’intégrité structurelle du tissu, ce qui aide à maintenir l’architecture tissulaire. Une autre option consiste à cryoconserver (congeler) vos échantillons, ce qui peut être une meilleure option si vous tentez de détecter une cible phosphorylée.
Récupération de l’antigène (épitope)
Les fixatifs utilisés pour préserver l’intégrité structurelle de l’échantillon de tissu présentent également des inconvénients car ils peuvent enterrer l’épitope que votre anticorps est conçu pour reconnaître.
Plusieurs méthodes existent pour révéler les épitopes qui ont été masqués par la fixation. Il s’agit notamment de la récupération d’antigènes induite par la protéolyse, qui repose sur une enzyme comme la protéinase K, ou de la récupération d’épitopes induite par la chaleur (HIER), qui utilise la chaleur pour briser les liaisons réticulées et dérouler les protéines. L’une ou l’autre méthode peut démasquer les épitopes, les rendant accessibles à l’anticorps primaire et se prêtant à la coloration par IHC.
A la CST, notre méthode de récupération des antigènes la plus courante est la HIER. Cependant, nos scientifiques testent plusieurs méthodes de récupération d’antigènes pour déterminer les conditions optimales d’utilisation de chaque anticorps en IHC. Le protocole recommandé par la CST se trouve sur la fiche technique de tout anticorps validé pour l’IHC.
La liaison de l’anticorps
La sélection du bon anticorps est l’une des étapes les plus critiques pour obtenir un résultat d’IHC réussi. Tous les anticorps validés IHC de CST sont vérifiés non seulement comme ayant un signal fort dans les tissus, mais subissent une procédure de validation rigoureuse pour confirmer la spécificité du signal. Nos scientifiques, spécialisés dans l’IHC, testent un grand nombre d’anticorps et ne recommandent que ceux qui sont les mieux adaptés à l’application.
Cliquez ici pour parcourir les anticorps validés par IHC pour votre cible.
Systèmes de détection
La coloration par immunohistochimie (IHC) permet 2 grandes classes de détection : 1) chromogène et 2) fluorescente. Pour la détection chromogène, la CST recommande d’utiliser des systèmes à base de polymères qui évitent les limites du système à base de biotine tout en augmentant la sensibilité du test.
Essayez le réactif de détection SignalStain® Boost IHC (HRP, lapin) #8114 ou le réactif de détection SignalStain® Boost IHC (HRP, souris) #8125 selon l’espèce hôte de votre anticorps primaire.

La détection à base de polymères est plus sensible que les systèmes à base de biotine. Analyse IHC d’un carcinome pulmonaire humain inclus en paraffine utilisant Sox2 (D6D9) XP® Rabbit mAb #3579 et une détection à base de biotine (à gauche) ou une détection à base de polymère (SignalStain® Boost IHC Detection Reagent #8114 ; à droite). Comme indiqué, la détection à base de polymères offre une sensibilité accrue et donne lieu à une coloration plus robuste.
La détection à base de polymères est plus sensible que les systèmes à base de biotine. Analyse IHC d’un carcinome pulmonaire humain inclus en paraffine utilisant Sox2 (D6D9) XP® Rabbit mAb #3579 et une détection à base de biotine (à gauche) ou une détection à base de polymère (SignalStain® Boost IHC Detection Reagent #8114 ; à droite). Comme on le voit, la détection à base de polymère offre une sensibilité accrue et donne lieu à une coloration plus robuste.

Tous les substrats DAB n’ont pas les mêmes performances. Analyse IHC d’un carcinome mammaire humain inclus en paraffine utilisant Phospho-Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145. La détection chromogène a été réalisée à l’aide du kit de substrat DAB SignalStain® n° 8059 (à gauche), du DAB fourni par le concurrent 1 (au milieu) ou du DAB fourni par le concurrent 2 (à droite). Bien que le DAB du concurrent 2 produise un signal comparable à celui du kit de substrat DAB SignalStain®, le DAB du concurrent 1 donne un signal beaucoup plus faible.
Tous les substrats DAB n’ont pas les mêmes performances. Analyse IHC d’un carcinome mammaire humain inclus en paraffine utilisant Phospho-Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145. La détection chromogène a été réalisée à l’aide du kit de substrat DAB SignalStain® n° 8059 (à gauche), du DAB fourni par le concurrent 1 (au milieu) ou du DAB fourni par le concurrent 2 (à droite). Bien que le DAB du concurrent 2 produise un signal comparable à celui du kit de substrat SignalStain® DAB, le DAB du concurrent 1 produit un signal beaucoup plus faible.
Contre-coloration
Après la détection des anticorps, de nombreux chercheurs préfèrent contre-colorer le tissu pour visualiser l’anatomie cellulaire et orienter le spectateur par rapport à la coloration spécifique. À la CST, nous contre-colorons nos échantillons en utilisant l’hématoxyline #14166, qui colore le noyau en bleu. Lorsque vous choisissez une contre-coloration, il est important qu’elle soit compatible avec votre chromogène. Par exemple, si la couleur du contre-colorant est trop similaire à celle du chromogène, le signal de l’anticorps sera difficile à reconnaître.
Protocole de coloration par immunohistochimie (IHC)
Vous trouverez ci-dessous un aperçu de notre protocole recommandé et mis en évidence les étapes clés pour une expérience réussie. CST vise à vous aider à améliorer votre analyse IHC en fournissant des anticorps et des réactifs validés pour vous permettre de suivre un protocole simple, spécifique au produit et d’obtenir des résultats reproductibles avec un minimum d’optimisation nécessaire.
Voir la vidéo du protocole IHC ou visiter notre page de sélection des protocoles.