Introduction
Selon l’Organisation mondiale de la santé, la dépression touche environ 350 millions de personnes dans le monde (Organisation, 2017). Les patients atteints de dépression indiquent des symptômes de troubles anxieux et s’accompagnent d’une incapacité à éprouver du plaisir et de l’intérêt, d’une perte de concentration, d’un doute sur soi, d’une anxiété sociale, de troubles du sommeil et de l’appétit (Namola et al., 2015). Les principaux facteurs à l’origine de la dépression sont des déséquilibres chimiques ou hormonaux dans le cerveau. La principale hormone associée à la dépression est la sérotonine. Les autres hormones sont la norépinéphrine et la dopamine (Yi et al., 2008). Ces hormones sont nécessaires au fonctionnement normal du cerveau et au contrôle des sentiments. La destruction de ces hormones peut provoquer un déséquilibre chimique dans le cerveau entraînant la dépression.
La dépression peut être traitée selon sa gravité, par une psychothérapie ou des médicaments. Les antidépresseurs sont les principaux types de médicaments utilisés pour traiter la dépression. Il existe de nombreux types d’antidépresseurs, qui ne diffèrent que par leur mode d’action sur le cerveau, leur coût et leur profil d’effets secondaires. En traitement de première intention, la plupart des patients se voient prescrire soit un antidépresseur tricyclique (ATC), soit un inhibiteur sélectif de la recapture de la sérotonine (ISRS ; McCarthy et al., 2016). Les médicaments couramment utilisés pour les traitements de l’anxiété sont les benzodiazépines. Bien qu’il existe sur le marché de nombreux médicaments antidépresseurs utilisés pour traiter la dépression, les effets secondaires de l’utilisation de ces médicaments sont très préoccupants (Binfaré et al., 2009). Une thérapie alternative de la dépression est l’utilisation de plantes médicinales (Fajemiroye et al., 2016). L’utilisation d’extraits de plantes médicinales est de plus en plus acceptée par le corps médical et par les patients. La majorité des remèdes à base de plantes utilisés pour le traitement de la dépression sont des extraits bruts ou semi-purifiés (Calixto et al., 2000 ; Carlini, 2003 ; Guan et Liu, 2016).
Les rapports sur les recherches impliquant le principe actif capable d’induire une activité sur le système nerveux central (SNC) sont rares. Une revue par Carlini (2003) comprend des informations de seulement sur les effets psychoanaleptiques, psycholeptiques, et psychodysleptiques. Une revue récente de Guan et Liu (2016) a discuté de la relation structure-activité des effets antidépresseurs des flavonoïdes isolés de sources naturelles et synthétiques. Les alcaloïdes indoliques synthétiques, leur activité et leur utilisation potentielle en médecine ont déjà été examinés dans plusieurs articles (de Sa et al., 2009). Cependant, aucun article de synthèse n’a été publié établissant une corrélation entre les alcaloïdes indoliques végétaux isolés et l’activité antidépressive. Cette revue fournit des informations sur le potentiel des alcaloïdes indoliques naturels pour le traitement des troubles neurologiques, les études de relation structure-activité, et l’étendue de ceux-ci à d’autres métabolites bioactifs comme pistes potentielles de médicaments antidépresseurs du point de vue de la structure chimique. Il est compilé par une enquête bibliographique des journaux scientifiques et de la littérature pertinente identifiée par les bases de données électroniques Web of Science.
Plantes antidépressives
Cet article de synthèse traite des plantes possédant une activité sur le SNC. Bien que de nombreux types de plantes entrent dans cette catégorie, nous ne mettrons en avant que les plantes qui présentent des propriétés antidépressives. Deux plantes qui contiennent des alcaloïdes indoliques sont Passiflora incarnata L. (passiflore) et Mitragyna speciosa (Korth.) Havil (kratom), tandis que les deux autres plantes qui n’ont pas montré la présence d’alcaloïdes indoliques, Piper methysticum G. Forst (kava) et Valeriana officinalis L., méritent une attention particulière. La structure chimique des composés isolés de ces plantes peut être utilisée comme base pour le développement de nouveaux médicaments.
Passiflora incarnata et d’autres espèces comme P. alata Curtis, P. coerulea L. et P. edulis Sims sont largement utilisées comme sédatif dans la médecine traditionnelle dans la plupart des pays européens et en Amérique (Houghton et Seth, 2003). La structure des benzodiazépines est constituée d’un noyau benzénique fusionné à un système diazépine comprenant un fragment hétérocyclique à sept chaînons avec deux atomes d’azote en positions 1 et 2 du cycle. Les alcaloïdes indoliques isolés de P. incarnata à savoir l’harman, l’harmol, l’harmine, l’harmalol et l’harmaline sont constitués d’un cycle benzénique fusionné à un hétérocycle à cinq membres contenant un atome d’azote.
Plusieurs études ont indiqué que P. incarnata a un profil pharmacologique similaire aux benzodiazépines et agit par le biais des récepteurs de l’acide gamma-aminobutyrique (GABA) (Jawna-Zboiñska et al, 2016). Les feuilles de M. speciosa ont été utilisées comme médecine traditionnelle pour traiter la diarrhée, le diabète et pour améliorer la circulation sanguine (Vicknasingam et al., 2010). La mitragynine est le principal alcaloïde indole présent dans M. speciosa avec ses analogues, la speciogynine, la paynantheine et la speciociliatine (León et al., 2009). Deux études menées sur l’extrait aqueux et l’extrait alcaloïde de M. speciosa ont induit un effet de type antidépresseur sur des modèles murins de désespoir comportemental (Kumarnsit et al., 2007). Une étude menée par Idayu et al. (2011) sur la mitragynine montre l’effet des antidépresseurs dans le modèle comportemental animal de la dépression par l’interaction avec l’axe hypothalamo-hypophyso-surrénalien (HPA) dans le système neuroendocrinien (Idayu et al., 2011).
Piper methysticum G. Forst est consommé comme une boisson appelée kava qui induit un état mental agréable vers le sentiment de gaieté tout en réduisant la fatigue et l’anxiété (Bilia et al., 2002). L’étude montre que la plupart des activités pharmacologiques sont conservées dans l’extrait liposoluble par rapport à l’extrait aqueux. L’extrait liposoluble contient au moins sept pyrones, connus sous le nom de kavalactone. Les kavalactones interagissent généralement avec les neurotransmissions dopaminergiques, sérotoniques, de l’acide gamma aminobutyrique (GABA), glutamatergiques, empêchent la monoamine oxydase B (MOB) et fournissent également une variété d’effets sur les canaux ioniques (Grunze et al., 2001). La dihydrométhysticine est l’une des six principales kavalactones présentes dans le kava. La structure de la dihydrométhysticine comprend une aryléthylène-α-pyrone liée à un groupement de type indole comprenant deux oxygènes à la place des azotes. Elle contribue à l’activité anxiolytique et agit comme un antidépresseur. Des études en double aveugle contrôlées par placebo ont démontré que les kavalactones exercent une activité anxiolytique sans déprimer les fonctions mentales et motrices et améliorent la qualité du sommeil. Les kavalactones sont une alternative pour remplacer l’utilisation des benzodiazépines dans la thérapie de la dépression (Malsch et Kieser, 2001).
Valeriana officinalis L., également connu sous le nom de valériane est largement utilisé par de nombreux pays comme sédatif, anticonvulsif, pour les effets hypnotiques, et l’activité anxiolytique (Ghaderi et Jafari, 2014). L’acide valérénique et les valépotriates ont été signalés comme des ingrédients actifs dans les préparations pharmaceutiques et les extraits bruts commerciaux de valériane ont enregistré une utilisation dans de nombreux pays (Bos et al., 2002). Les valépotriates qui comprennent des triesters de polyhydroxycyclopenta-(c)-pyranes avec les acides carboxyliques : acétique, valérique, isovalérique, α-isovaléroxy-isovalérique, β-méthylvalérique, β-acétoxy-isovalérique, β-hydroxyisovalérique et β-acétoxy-β-méthylvalérique, sont utilisés comme sédatifs. Les valépotriates sont instables, thermolabiles et se décomposent rapidement dans des conditions acides ou alcalines dans l’eau, ainsi que dans des solutions alcoolisées (Bos et al., 2002). Les valépotriates sont utiles pour améliorer les conditions animales et humaines pendant les sevrages de benzodiazépines (Poyares et al…, 2002).
Bien qu’il existe une variété de différents constituants chimiques, le mécanisme d’action est rapporté comme l’interaction de la valériane avec le système GABA dans le cerveau par l’inhibition de la GABA transaminase, l’interaction avec le récepteur GABA/benzodiazépine et l’interférence dans l’absorption et le recrutement d’admission de GABA dans les synaptosomes (Sichardt et al., 2007). Divers modèles ont été utilisés pour étudier les effets antidépresseurs des plantes. Des modèles pharmacodynamiques comprenant des modèles in vitro, in vivo et cliniques ont été utilisés pour évaluer les effets (tableau 1). La majorité des espèces végétales sélectionnées ont été étudiées in vivo, quelques-unes ont été étudiées in vitro et seul le kava a fait l’objet d’essais cliniques. Dans tous les cas, des recherches supplémentaires doivent être menées pour établir les composés actifs, la dose la plus efficace et pour déterminer si cela varie entre les différents types de dépressions.

TABLE 1. Informations des études pharmacologiques des plantes examinées.
Alcaloïdes indoliques
Les alcaloïdes indoliques ont une structure bicyclique, constituée d’un cycle benzénique à six chaînons fusionné à un cycle pyrrole à cinq chaînons contenant de l’azote. Ce cycle pyrrole avec atome d’azote donne lieu aux propriétés de base des alcaloïdes indoliques qui les rendent particulièrement actifs sur le plan pharmacologique (El-Sayed et Verpoorte, 2007). Les alcaloïdes indoliques sont largement distribués dans les plantes appartenant aux familles Apocynaceae, Loganiaceae, Rubiaceae, et Nyssaceae. Parmi les alcaloïdes indoliques importants qui ont été isolés à partir de plantes, on trouve le médicament antihypertenseur, la réserpine de Rauvolfia serpentina (Sagi et al., 2016) et les puissants médicaments antitumoraux, la vinblastine et la vincristine de Catharanthus roseus (El-Sayed et Verpoorte, 2007). Les études sur l’efficacité des alcaloïdes indoliques dans le traitement de la dépression ne sont pas nouvelles et ont été menées depuis 1952, mais actuellement très peu d’attention a été accordée par la communauté scientifique aux bénéfices de l’utilité thérapeutique des plantes dotées de propriétés antidépressives.
Les alcaloïdes indoliques sont souvent associés à la fonction des récepteurs de la protéine G, en particulier pour la transmission des signaux neuronaux à travers les récepteurs de la sérotonine (5-HT/hydroxytryptamine). Outre le donneur d’hydrogène via le N-H libre, la présence d’une densité d’électrons π contribue à l’énergie de l’orbite moléculaire la mieux occupée (HOMO) du squelette indole plan. Ceci permet une interaction avec les nucléobases, en particulier l’atome protoné ainsi que les protéines cibles (de Sa et al., 2009). La structure chimique du neurotransmetteur sérotonine est basée sur un cycle indole aromatique riche en électrons. La présence d’un atome d’azote dans le cycle indole permet de maintenir le système aromatique et rend la liaison N-H acide plutôt que basique. Le cycle indole est capable de former des liaisons hydrogène par le biais de la fraction N-H et des interactions π-π stacking ou cation-π, via la fraction aromatique (Shimazaki et al., 2009). L’hydrophobie des cycles indole est presque la même que celle de la sous-unité phényle et moins hydrophobe que celle des cycles isostériques classiques benzothiophène et benzofurane. Le groupe indole N-H joue un rôle décisif dans l’interaction avec le biorécepteur cible alors que les dérivés synthétisés du benzothiophène et du benzofurane présentent une affinité modérée à limitée pour le biorécepteur cible (de Sa et al., 2009). La réserpine est l’un des exemples d’alcaloïdes indoliques isolés au cours des 60 dernières années qui présentent une action sédative sur le SNC. D’ailleurs, deux substances chimiques, à savoir la tryptamine et la sérotonine présentes dans le cerveau, sont également des dérivés d’alcaloïdes indoliques.
À l’heure actuelle, les constituants actifs des extraits de plantes responsables de l’effet antidépresseur ne sont toujours pas clairs. Ainsi, nous essayons d’identifier quelques structures chimiques importantes isolées d’extraits de plantes présentant des activités antidépressives et de vérifier la similitude du modèle de squelette qui pourrait contribuer à l’activité antidépressive. Les premières tentatives ont été faites pour identifier les similitudes structurelles entre la sérotonine et les alcaloïdes indoliques. La similitude la plus nette consiste en des cycles hétérocycliques à six membres fusionnés à des cycles à cinq membres. La différence réside dans la présence d’un atome d’azote ou dans la distribution des électrons π (figure 1). Grâce à une étude de relation structure-activité, Nichols (2012) a rapporté que la variation de l’activité de différents types de molécules suggère que le récepteur est très sensible à la nature de la tryptamine. D’autres composés chimiques qui sont isolés avec succès à partir de plantes antidépressives sont mentionnés dans cet article de synthèse parce qu’ils sont peut-être des agonistes spécifiques avec des schémas de substitution particuliers capables d’activer sélectivement un sous-ensemble d’effecteurs. Ce phénomène est maintenant connu sous le nom de sélectivité fonctionnelle.
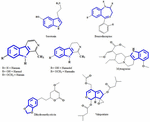
FIGURE 1. Structures chimiques de la sérotonine, de la benzodiazépine et des composés isolés de plantes antidépressives. Similitude dans le modèle de squelette, qui consiste en des anneaux hétérocycliques à six membres, attachés avec des anneaux à cinq membres.
La sérotonine, est largement utilisée dans la fonction cérébrale et la cognition comme agoniste du récepteur endogène (Fink et Göthert, 2007). La sérotonine exerce ses fonctions par l’intermédiaire de sept familles de récepteurs (5-HT1-5-HT7) qui sont membres de la famille des récepteurs couplés à la protéine G. Un certain nombre de composés portant la fraction indole ont été décrits comme ayant une affinité avec différents récepteurs de la sérotonine (Kochanowska-Karamyan et Hamann, 2010). La similarité structurelle des alcaloïdes indoliques (agonistes exogènes) avec les neurotransmetteurs endogènes comme la sérotonine a conduit les chercheurs à prédire l’activité neurologique potentielle de ces molécules. Le schéma des processus associés à la neurotransmission des agonistes exogènes est décrit dans la figure 2.
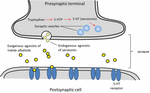
FIGURE 2. Schéma des processus associés à la neurotransmission. Agonistes exogènes d’alcaloïdes indoliques provenant de plantes partageant des similitudes de structure avec la sérotonine qui leur permet de se lier dans les récepteurs de la sérotonine (récepteurs 5-HT).
Le cycle indole est également connu sous le nom de bioisostères et a des similitudes chimiques et physiques comme les molécules biologiques. Cette similitude est utilisée dans le développement du prototype de médicament qui vise à améliorer l’activité pharmacologique et à optimiser le profil pharmacocinétique. Dans une autre étude d’évaluation pharmacologique des benzofuranes et du thiénopyrrole, on a obtenu des molécules bioisostères qui possèdent une activité semblable à celle de la diméthyltryptamine. Les premiers travaux réalisés avec des benzothiophènes et des 3-indénalkylamines ont démontré que pour les composés dépourvus de substituants cycliques, la capacité à agir comme agonistes dans le fundus du rat était à peu près la même que celle des tryptamines. Les résultats ont révélé que le NH de l’indole n’était pas essentiel pour activer le récepteur 5-HT2 dans le fundus du rat (Nichols, 2012). Une série d’antagonistes des récepteurs NK1 2-aryl indole et leurs dérivés sont de bons ligands mais ont une faible biodisponibilité orale chez le rat. Afin d’augmenter la solubilité et l’absorption, l’azote basique a été introduit, ce qui a conduit à l’azaindole analogue et aux composés apparentés présentant la même affinité de liaison au NK1 que la série d’antagonistes du récepteur NK1 2-aryl indole (Cooper et al., 2001). Le docking moléculaire de 2 ligands dérivés du phényl-indole avec les récepteurs de la sérotonine 5-HT6 et de la mélanocortine-4 indique que l’échafaudage privilégié peut s’adapter en fonction de la nature de la sous-poche conservée et de la poche de liaison non conservée. Les interactions des parties non conservées de la poche de liaison sont responsables de différences importantes dans la reconnaissance moléculaire par le récepteur cible correspondant (Bondensgaard et al…, 2004).
Selon de Sa et al. (2009) les alcaloïdes indoliques communs trouvés dans les sources naturelles sont les acides aminés du tryptophane dans la nutrition humaine et la découverte d’hormones végétales qui ont des effets thérapeutiques tels que les anti-inflammatoires, un inhibiteur de la phosphodiestérase, les agonistes et antagonistes des récepteurs 5-HT, les agonistes des récepteurs cannabinoïdes et les inhibiteurs de la HMG-CoA réductase. L’échafaudage de l’indole a des poches de liaison et possède un domaine de liaison complémentaire commun au récepteur cible, qui appartient à une classe de RCPG (récepteurs membranaires couplés importants pour les protéines G). La plupart des médicaments sur le marché contiennent la sous-structure indole. Il s’agit notamment de l’indométhacine, de l’ergotamine, du frovatriptan, de l’ondansétron et du tadalafil.
Conclusion
Cette revue a révélé qu’une majorité des remèdes à base de plantes indiqués pour le traitement des affections psychiatriques étaient bruts ou semi-purifiés. Les résultats in vivo et in vitro varient et ne sont pas reproductibles car, dans différentes régions biogéographiques, la teneur en métabolites secondaires des plantes est corrélée à la disponibilité des nutriments, au climat et aux conditions écologiques. En outre, la bioactivité des plantes peut être due à un seul composé ou à un mélange de composés. Les auteurs suggèrent que l’effort pour obtenir des principes actifs, l’identification des phytochimiques et l’étude de la métabolomique devraient être menés avec des inspections in vitro et in vivo pour une meilleure caractérisation des médicaments à base de plantes. Dans la plupart des cas, la synthèse des alcaloïdes indoliques a été inspirée par les molécules naturelles et leur similitude avec la sérotonine.
Les alcaloïdes indoliques de sources végétales sont assez complexes par rapport aux synthétiques. L’importance des alcaloïdes indoliques synthétiques est déjà établie car la structure est disponible dans divers récepteurs ligands, inhibiteurs d’enzymes et modulateurs biorécepteurs. Certains des alcaloïdes indoliques naturels ne peuvent pas être synthétisés par les méthodes actuellement connues. En outre, la plupart des informations sur l’efficacité des alcaloïdes indoliques ont été rapportées à partir d’alcaloïdes indoliques synthétiques. Par conséquent, le potentiel de nombreux alcaloïdes indoliques naturels en tant que nouveaux médicaments pour divers troubles psychiatriques est encore inexploité. Historiquement, les composés d’origine végétale ont été à l’origine de plusieurs des pistes de médicaments les plus fructueuses ou des médicaments utilisés en médecine. En conclusion, plusieurs alcaloïdes indoliques ont été utilisés comme antidépresseurs ou fournissent des structures de tête pour leur développement. Sur la base de nos résultats, les plantes contiennent un réservoir d’alcaloïdes indoliques qui sont des points de départ précieux pour le développement de futurs antidépresseurs.
Contributions de l’auteur
HH : Préparation du manuscrit. MY : Éditer la langue anglaise et suggérer certaines informations importantes afin d’améliorer le manuscrit. AR : Contribuer à la compréhension du schéma des processus associés à la neurotransmission.
Funding
Le soutien à ce travail a été fourni par l’Universiti Malaysia Pahang via la subvention de recherche UMP RDU170302 à HH.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Bilia, A. R., Gallori, S., et Vincieri, F. F. (2002). Kava-kava et l’anxiété : connaissances croissantes sur l’efficacité et la sécurité. Life Sci. 70, 2581-2597. doi : 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., and Rodrigues, A. L. S. (2009). L’administration d’acide ascorbique produit un effet de type antidépresseur : preuve de l’implication de la neurotransmission monoaminergique. Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi : 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., et Bywater, R. P. (2004). Reconnaissance de structures privilégiées par les récepteurs couplés aux protéines G. J. Med. Chem. 47, 888-899. doi : 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., et Pras, N. (2002). Détermination des valepotriates. J. Chromatogr. A 967, 131-146. doi : 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., and Yunes, R. A. (2000). Substances antinociceptives naturelles provenant de plantes. Phytother. Res. 14, 401-418. doi : 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). Les plantes et le système nerveux central. Pharmacol. Biochem. Behav. 75, 501-512. doi : 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl indole NK 1 receptor antagonists : optimisation of indole substitution. Bioorg. Med. Chem. Lett. 11, 1233-1236. doi : 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., et Alberto, C. (2009). De la nature à la découverte de médicaments : l’échafaudage indole comme une « structure privilégiée ». Mini Rev. Med. Chem. 9, 782-793. doi : 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., and Verpoorte, R. (2007). Alcaloïdes indoliques terpénoïdes de Catharanthus : biosynthèse et régulation. Phytochem. Rev. 6, 277-305. doi : 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., and Costa, E. A. (2016). Traitement de l’anxiété et de la dépression : les plantes médicinales en rétrospective. Fundam. Clin. Pharmacol. 30, 198-215. doi : 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., et Weiss, G. (2011). Études pharmacologiques d’une association médicamenteuse à base de millepertuis (Hypericum perforatum) et de passiflore (Passiflora incarnata) : preuves in vitro et in vivo de la synergie entre Hypericum et Passiflora dans des modèles pharmacologiques antidépresseurs. Fitoterapia 82, 474-480. doi : 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., et Göthert, M. (2007). Régulation de la libération des neurotransmetteurs par les récepteurs 5-HT. Pharmacol. Rev. 59, 360-417. doi : 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., et Jafari, M. (2014). Régénération efficace des plantes, fidélité génétique et accumulation de haut niveau de deux composés pharmaceutiques dans les plantes régénérées de Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi : 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., et Walden, J. (2001). Les pyrones de Kava exercent des effets sur la transmission neuronale et les courants cationiques transmembranaires semblables à ceux des stabilisateurs d’humeur établis – une revue. Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., et Liu, B.-Y.. (2016). Effets de type antidépresseur et mécanismes des flavonoïdes et des analogues apparentés. Eur. J. Med. Chem. 121, 47-57. doi : 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., et Winterhoff, H. (2008). Des extraits de Valeriana officinalis L. sl montrent des effets anxiolytiques et antidépresseurs mais pas de propriétés sédatives ni myorelaxantes. Phytomedicine 15, 2-15. doi : 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., et Seth, P. (2003). Les plantes et le système nerveux central. Pharmacol. Biochem. Behav. 75, 497-499. doi : 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. (2011). Effet antidépresseur de la mitragynine isolée de Mitragyna speciosa Korth dans un modèle de dépression chez la souris. Phytomedicine 18, 402-407. doi : 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). Passiflora incarnata L. améliore la mémoire spatiale, réduit le stress et affecte la neurotransmission chez les rats. Phytother. Res. 30, 781-789. doi : 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., et Hamann, M. T. (2010). Alcaloïdes indoliques marins : nouvelles pistes potentielles de médicaments pour le contrôle de la dépression et de l’anxiété. Chem. Rev. 110, 4489-4497. doi : 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., et Intasaro, P. (2007). Immunoréactivité de type Fos dans les noyaux du raphé dorsal du rat induite par un extrait alcaloïde de Mitragyna speciosa. Neurosci. Lett. 416, 128-132. doi : 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., et Cutler, S. J. (2009). Caractérisation phytochimique des feuilles de Mitragyna speciosa cultivées aux États-Unis. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., et Kieser, M. (2001). Efficacité du kava-kava dans le traitement de l’anxiété non psychotique, après un prétraitement aux benzodiazépines. Psychopharmacologie 157, 277-283. doi : 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., et Dijk, D.-J. (2016). Homéostasie du sommeil paradoxal en l’absence de sommeil paradoxal : Effets des antidépresseurs. Neuropharmacologie 108, 415-425. doi : 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., et Kothiyal, P. (2015). Dépression et rôle des biomatériaux marins : une revue. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). Relations structure-activité des agonistes de la sérotonine 5-HT 2A. FILs Membr. Transp. Signaling 1, 559-579. doi : 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organisation, W. H. (2017). Fiche d’information sur la dépression 2016. Disponible à : http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., et Tufik, S. (2002). La valériane peut-elle améliorer le sommeil des insomniaques après le sevrage des benzodiazépines ? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., et Khan, I. A. (2016). Quantification et caractérisation des alcaloïdes des racines de Rauwolfia serpentina en utilisant la chromatographie liquide à ultra-haute performance-photo diode array-spectrométrie de masse. Anal. Bioanal. Chem. 408, 177-190. doi : 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., et Deed, G. (2009). The Kava Anxiety Depression Spectrum Study (KADSS) : a randomized, placebo-controlled crossover trial using an aqueous extract of Piper methysticum. Psychopharmacologie 205, 399-407. doi : 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., et Yamauchi, O. (2009). Complexes métalliques impliquant des cycles indole : structures et effets des interactions métal-indole. Coord. Chem. Rev. 253, 479-492. doi : 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., and Nieber, K. (2007). Modulation des potentiels postsynaptiques dans les neurones corticaux de rat par des extraits de valériane macérés avec différents alcools : implication des récepteurs adénosine A1 et GABAA. Phytother. Res. 21, 932-937. doi : 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., et Mansor, S. M. (2010). L’utilisation informelle du ketum (Mitragyna speciosa) pour le sevrage des opioïdes dans les États du nord de la Malaisie péninsulaire et les implications pour la thérapie de substitution des médicaments. Int. J. Drug Policy 21, 283-288. doi : 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., et Naidu, M. (2016). L’extrait de feuille de Mitragyna speciosa présente un effet de type antipsychotique avec le potentiel d’atténuer les symptômes positifs et négatifs de la psychose chez les souris. Front. Pharmacol. 7:464. doi : 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q. et Kong, L.-D. (2008). Antidepressant-like behavioral and neurochemical effects of the citrus-associated chemical apigenin. Life Sci. 82, 741-751. doi : 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar