Contexte
Artemisia annua est une herbe médicinale chinoise (également connue sous le nom de « qing hao » ou « absinthe douce ») dont l’activité antipaludique est bien prouvée (1). Les combinaisons thérapeutiques à base de dérivés de l’artémisinine (ACT) sont recommandées par l’Organisation mondiale de la santé (OMS) pour le traitement du paludisme non compliqué en association avec des agents antipaludiques efficaces (2). La chimioprophylaxie pour les voyageurs dépend de la destination de voyage où le paludisme est endémique et comprend une combinaison d’atovaquon/proguanil, de chloroquine, de doxycycline, de méfloquine ou de primaquine (3, 4). Des cas d’infection palustre sous chimioprophylaxie à base d’artémisinine ont été décrits (5) et l’OMS ne recommande pas l’utilisation de matériel végétal A. annua, sous quelque forme que ce soit, y compris le thé, pour le traitement ou la prévention du paludisme (6).
Les compléments alimentaires et à base de plantes (HDS) sont de plus en plus utilisés dans le monde entier et les lésions hépatiques induites par les HDS deviennent une préoccupation croissante (7). Malgré l’utilisation extensive des ACT dans les zones d’endémie palustre, les lésions hépatiques dérivées de l’artémisinine sont rares (8, 9). Kumar a rapporté le cas d’un patient qui a développé une lésion hépatique cholestatique 6 semaines après avoir pris par voie orale un supplément à base de plantes contenant de l’artémisinine pour des raisons de santé générale (10). Il existe quelques autres publications relatives aux lésions hépatiques induites par Artemisia annua (9, 11-14). Une directive clinique pour l’évaluation de la causalité et le diagnostic des lésions hépatiques induites par les plantes a récemment été proposée par l’Association chinoise de médecine chinoise (15). Nous présentons un cas d’hépatite cholestatique aiguë due à la prise de thé Artemisia en tant que chimioprophylaxie chez un patient revenant d’Éthiopie.
Rapport de cas
Un homme de 51 ans s’est présenté au service des urgences de l’hôpital universitaire de Bâle, en Suisse, avec des malaises, un inconfort abdominal, des selles jaunes flottantes, une jaunisse et une cholurie d’une durée de 4 jours et une perte de poids de 6-8 kg au cours des 6 dernières semaines. Il était revenu d’un voyage de 4 semaines en Éthiopie 3 semaines avant de consulter un médecin. Pendant son séjour en Éthiopie, il a consommé quotidiennement 1,25 g de thé en poudre Artemisia annua comme chimioprophylaxie contre le paludisme. Dans environ 90% des cas, il a dilué la poudre dans de l’eau bouillante, dans les 10% restants, la poudre a été ingérée mélangée à de la nourriture. Le supplément avait été acheté sur Internet. Le patient nous a remis le récipient, qui contenait à l’origine 50 g d’une poudre vert foncé (Figure 1). Lors de la présentation, 2 g se trouvaient dans le récipient, ce qui indique qu’il avait consommé un total de 48 g. Pendant son séjour en Éthiopie, il avait également consommé d’autres préparations semblables au thé. A notre connaissance, il n’y a pas d’hépatotoxicité décrite liée à ces substances. Il a nié prendre tout autre médicament sur ordonnance, en vente libre ou à base de plantes. Il n’avait pas d’antécédents ou d’antécédents familiaux de maladie du foie, d’abus d’alcool ou de drogues, ni de facteurs de risque d’hépatite virale. Il a signalé que sa femme, qui l’accompagnait lors de son voyage en Éthiopie, avait également consommé du thé Artemesia annua pour la prophylaxie du paludisme. Elle est restée en bonne santé tout au long du voyage.

Figure 1. Thé à base de poudre d’Artemisia annua.
En dehors d’un ictère marqué, il était en bon état général et avait des signes vitaux non remarquables (afébrile avec une pression artérielle, une fréquence cardiaque et une fréquence respiratoire normales).
Les analyses de laboratoire ont révélé : alanine aminotransférase (ALAT) 91 U/L (normale, 9-59) ; aspartate aminotransférase (ASAT) 42 U/L (normale, 9-34) ; phosphatase alcaline (ALP) 151 U/L (normale, 40-130) ; gamma-glutamyl transférase (GGT) 416 U/L (normale, 12-68) ; bilirubine totale 186.6 μmol/L (normale, 0-24) (bilirubine conjuguée 168,5 μmol/L) ; et rapport international normalisé (INR) 0,9 (normal, 0,9-1,3). Le taux d’acide biliaire était élevé à un niveau al de 460,5 μmol/L (normal, 0-8,0). L’hémogramme différentiel et la protéine c-réactive étaient normaux. Une légère hyponatrémie et une hypochlorémie étaient présentes, cohérentes avec l’augmentation de l’apport hydrique du patient au cours des jours précédents. Les tests sérologiques pour l’hépatite aiguë A, B, C et E, le virus d’Epstein-Barr et l’infection à cytomégalovirus étaient négatifs. La coeruloplasmine était normale. Les auto-anticorps spécifiques du foie (anticorps anti-nucléaire, anticorps anti-neutrophile, anticorps anti-muscle lisse, anticorps anti-mitochondrial, anticorps anti-protéinase 3 et anticorps anti-myéloperoxydase) étaient négatifs et les IgA, IgM et IgG se situaient dans la fourchette normale. L’échographie abdominale a montré un parenchyme hépatique, des vaisseaux et des canaux biliaires normaux. L’élastographie du foie était élevée (FibroScan, 12,7 kPa, plage normale <5 kPa).
Le patient a également été évalué à l’Institut Tropical et de Santé Publique Suisse pour diverses conditions infectieuses sous-jacentes potentielles. Les anticorps contre la fièvre boutonneuse à rickettsia étaient positifs, cependant, cela a été considéré comme sans rapport avec la présentation clinique et aucune antibiothérapie n’a été commencée.
La biopsie hépatique initiale a montré une hépatite portale avec une infiltration lymphocytaire des canaux biliaires et une bilirubinostase intra-canaliculaire et intra-cytoplasmique diffuse. Aucune fibrose ni matériel parasitaire n’ont été observés (Figures 2A,B). Une analyse de séquençage de nouvelle génération sur l’ADN des leucocytes du sang périphérique pour les variantes génétiques dans les gènes codant pour les 3 transporteurs hépatiques les plus importants pour l’homéostasie des acides biliaires, à savoir BSEP, MDR3 et FIC1, n’a trouvé aucune variante typiquement associée aux maladies hépatiques cholestatiques héréditaires.
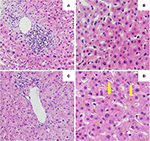
Figure 2. Histologie de la première (A,B) et de la deuxième (C,D) biopsie du foie. (A) Vue à faible puissance de la biopsie hépatique montrant un infiltrat lymphocytaire portal . (B) Parenchyme hépatique avec bilirubinostase intracellulaire (HE, 20x). (C) Vue à faible puissance d’une biopsie hépatique sans inflammation portale significative (HE, 10x). (D) Parenchyme hépatique avec bilirubinostase intracellulaire et extracellulaire significative (flèche) (HE, 20x).
L’analyse toxicologique du thé Artemisia par chromatographie liquide-spectrométrie de masse et chromatographie gazeuse-spectrométrie de masse a révélé les ingrédients suivants : arteannuin b, désoxyartémisine, camphre et scopoletine.
Un traitement par prednisone 20mg deux fois par jour et acide ursodésoxycholique 500 mg deux fois par jour a été initié. En raison d’un ictère persistant ainsi que d’une augmentation de la bilirubine sur 4 semaines malgré le traitement, une seconde biopsie du foie a été réalisée. La seconde biopsie a montré une bilirubinostase intracytoplasmique et intracanaliculaire sévère, avec une inflammation minime par rapport à la première biopsie (Figures 2C,D). Le traitement aux corticostéroïdes a été interrompu, l’acide ursodésoxycholique a été poursuivi jusqu’à la résolution de l’ictère et la normalisation de la bilirubine (15,3 μmol/l) (figure 3) et la diminution pertinente des acides biliaires (19,5 μmol/l) qui est survenue trois mois après le début de la maladie.
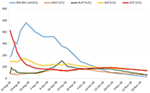
Figure 3. Évolution de la bilirubine et des enzymes hépatiques dans le temps.
Le cas a été signalé à l’unité de pharmacovigilance de l’autorité nationale suisse des produits thérapeutiques (Swissmedic). Un consentement éclairé écrit a été obtenu du participant pour la publication de ce rapport de cas.
Discussion
Les dérivés de l’artémisinine sont une pierre angulaire du traitement mais pas de la chimioprévention du paludisme (2). Malgré leur utilisation intensive, des lésions hépatiques dues aux dérivés de l’artémisinine ont rarement été décrites (8, 10). A notre connaissance, il s’agit du premier rapport de cas d’une hépatite cholestatique aiguë due à la prise de thé d’Artemisia annua.
Les lésions hépatiques induites par les plantes et les compléments alimentaires sont un sujet d’intérêt croissant depuis que les HDS sont de plus en plus utilisés dans le monde (7). La prise de HDS est souvent considérée comme inoffensive, cependant, un nombre croissant d’événements indésirables survenant parallèlement à leur utilisation ont été signalés (16). En outre, comme la concentration et la composition des HDS ne sont souvent pas déclarées sur les étiquettes des produits, la qualité et la quantité des ingrédients du produit restent inconnues. Dans notre cas, le diagnostic de lésion hépatique induite par les HDS et due à la prise de thé Artemisia annua était basé sur la forte relation temporelle entre l’exposition et le développement de l’effet indésirable et l’absence d’autres étiologies possibles. Nous avons calculé le score d’évaluation de la causalité selon la méthode RUCAM (Roussel Uclaf Causality Assessment Method) (17) et obtenu un score de 6 correspondant à une causalité » probable » du médicament incriminé. Les différents items ont été notés comme suit : délai d’apparition (+2), évolution (+1), facteurs de risque (+1), médicaments concomitants (-1), exclusion d’autres causes d’atteinte hépatique (+2), information antérieure sur l’hépatotoxicité du médicament (+1), réponse à la réadministration (0). Il n’y avait aucune autre étiologie identifiable de la maladie hépatique.
Le cas précédemment décrit par Kumar présentait un modèle hépatocellulaire de lésion hépatique, suivi d’une phase cholestatique prolongée (10). Notre patient a présenté un modèle prédominant de lésion hépatique cholestatique 5 semaines après la première ingestion de thé Artemisia annua. Nous supposons que l’histoire naturelle était similaire à celle du cas de Kumar, mais que notre patient s’est présenté à un stade ultérieur de l’évolution des lésions hépatiques. Dans l’analyse toxicologique de la tisane ingérée, nous avons identifié en plus la scopoletine et le camphre, qui sont naturellement présents dans l’Artemisia annua (18, 19) et qui peuvent avoir contribué à l’apparition de la lésion hépatique cholestatique.
Le mécanisme de la lésion hépatique induite par les dérivés de l’artémisinine reste peu clair. Les composants chimiques des Artemisiae spp comprennent des huiles volatiles, des flavonoïdes, des tanins, des triterpènes et des polysaccharides. Les huiles volatiles d’Artemisiae spp ont des activités pharmacologiques et une toxicité importantes, et une approche bioinformatique récente a identifié diverses voies pouvant être impliquées dans le développement de lésions hépatiques (20). La prédisposition aux lésions hépatiques cholestatiques induites par les médicaments a été associée à des polymorphismes de la pompe d’exportation des sels biliaires (21, 22). Nous avons donc recherché des variants dans les transporteurs d’acides biliaires par séquençage de nouvelle génération. Nous n’avons pas détecté de délétion, de duplication ou de variant pathologique dans les séquences des gènes ABCB11, ATP8B1 et ABCB4 (régions codantes et flanquantes) codant respectivement pour BSEP, FIC1 et MDR3 (Figure 4). Cependant, un certain nombre de variants de séquence communs ont été identifiés. Notre patient était porteur, à titre homozygote, d’un variant du gène ABCB11 . La question de savoir si ce polymorphisme est associé à la cholestase intrahépatique familière bénigne récurrente et/ou progressive et à la cholestase intrahépatique de la grossesse a été débattue (23, 24). De plus, un autre variant commun dans le gène ABCB11 a été détecté à l’état hétérozygote . Ce variant a été associé à une expression réduite de la protéine (25) et à la cirrhose biliaire primitive (26, 27). Cependant, ces deux variantes génétiques sont beaucoup trop fréquentes dans la population générale pour être responsables des maladies cholestatiques du foie (28). Le séquençage systématique du transcriptome dans de tels cas peut identifier des variants dans d’autres régions des séquences génétiques ou dans d’autres gènes codant pour d’autres transporteurs ou protéines hépatiques impliqués dans la génération de la bile, tels que ABCC2, ABCC3, ABCC4, et la protéine de jonction serrée 2 (TJP2), respectivement (21).
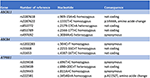
Figure 4. Analyse génétique moléculaire des gènes ABCB11, ABCB4, et ATP8B1.
En conclusion, nous décrivons un cas de lésion hépatique cholestatique sévère induite par l’HDS compatible avec la prise de thé Artemisia annua. Des efforts devraient être entrepris pour décourager l’utilisation des dérivés de l’artémisinine pour la prévention du paludisme, qui est inefficace selon les recommandations de l’OMS et peut en outre causer des dommages. En outre, ce cas démontre notre compréhension encore insuffisante de la physiopathologie et de la susceptibilité aux lésions hépatiques induites par l’HDS.
Data Availability Statement
Tous les ensembles de données de cette étude sont inclus dans le manuscrit/les fichiers complémentaires.
Ethics Statement
Un examen et une approbation éthiques n’ont pas été nécessaires pour le rapport d’un seul cas clinique ici, conformément à la législation locale et aux exigences institutionnelles. Le patient/participant a fourni son consentement éclairé écrit pour participer.
Contributions des auteurs
FR-R a rédigé la première version du manuscrit. SH, CB, AL-T, MZ et AJ ont rédigé des sections du manuscrit. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT et CB ont contribué à la gestion clinique du patient, à la révision du manuscrit, ont lu et approuvé la version soumise.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
1. Klayman DL. Qinghaosu (artémisinine) : un médicament antipaludique de Chine. Science. (1985) 228:1049-55. doi : 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Organisation mondiale de la santé. Directives de l’OMS pour le traitement du paludisme, 2e éd. (2010). Disponible en ligne à l’adresse suivante : http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (consulté le 23 novembre 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Disponible en ligne à l’adresse suivante : http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (consulté le 23 novembre 2018).
Google Scholar
4. Centres de contrôle et de prévention des maladies. Choisir un médicament pour prévenir le paludisme (2018). Disponible en ligne à l’adresse suivante : https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Mauvaise utilisation de l’artésunate et paludisme à Plasmodium falciparum chez un voyageur revenant d’Afrique. Emerg Infect Dis. (2010) 16:1608-10. doi : 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Organisation mondiale de la santé. OMS, déclaration de position. Efficacité des formes non pharmaceutiques d’Artemisia annua L. contre le paludisme. Genève : Organisation mondiale de la santé (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Lésions hépatiques dues aux suppléments à base de plantes et aux compléments alimentaires. Hepatology. (2017) 65:363-73. doi : 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Deux cas d’hépatite fulminante au cours d’un traitement curatif par une association artésunate-amodiaquine. Med Mal Infect. (2009) 39:57-60. doi : 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centres de contrôle et de prévention des maladies (CDC). Hépatite temporairement associée à un supplément à base de plantes contenant de l’artémisinine – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Lésion hépatique cholestatique secondaire à l’artémisinine. Hépatologie. (2015) 62:973-4. doi : 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. Un essai clinique pilote randomisé, contrôlé par placebo, pour étudier l’efficacité et la sécurité d’un extrait d’Artemisia annua administré pendant 12 semaines, pour gérer la douleur, la raideur et la limitation fonctionnelle associées à l’arthrose de la hanche et du genou. Clin Rheumatol. (2016) 35:1829-36. doi : 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Risque potentiel d’atteinte au foie – Déclaration au titre de l’article 98 du Medicines Act 1981 (2018). Disponible en ligne à l’adresse suivante : http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, informations cliniques et de recherche sur les lésions hépatiques induites par les médicaments. Dérivés de l’artémisinine. (2019). Disponible en ligne à : https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hépatotoxicité avec un supplément diététique naturel, Artemisia annua L. Extract in Grapeseed Oil. Rapports du centre de pharmacovigilance néo-zélandais. Sécurité des médicaments (2018). In : 18e réunion annuelle de l’ISoP « Pharmacovigilance sans frontières ». Genève (consulté du 11 au 14 novembre 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Lignes directrices pour le diagnostic et la gestion des lésions hépatiques induites par les herbes. Chin J Integr Med. (2018) 24:696-706. doi : 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Tendances dans l’utilisation des approches de santé complémentaires chez les adultes : États-Unis, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM dans les lésions hépatiques induites par les médicaments et les herbes : la mise à jour. Int J Mol Sci. (2015) 17:E14. doi : 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Différences dans les constituants chimiques d’Artemisia annua L de différentes régions géographiques en Chine. PLoS ONE. (2017) 12:e0183047. doi : 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variations des composants antipaludiques d’Artemisia annua Linn provenant de trois régions de l’Ouganda. Afr Health Sci. (2015) 15:828-34. doi : 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, et al. Analyse basée sur un réseau moléculaire du mécanisme des lésions hépatiques induites par les huiles volatiles d’Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi : 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. L’interférence avec la fonction de la pompe d’exportation des sels biliaires est un facteur de susceptibilité pour les lésions hépatiques humaines dans le développement de médicaments. Toxicol Sci. (2010) 118:485-500. doi : 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi : 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Mise à jour sur la cholestase intrahépatique familiale progressive. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi : 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy. Obstet Med. (2008) 1:65-71. doi : 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. Le rôle du sodium-taurocholate cotransporting polypeptide (NTCP) et de la pompe d’exportation des sels biliaires (BSEP) dans la physiologie et la physiopathologie de la formation de la bile. Handb Exp Pharmacol. (2011) 201:205-59. doi : 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. Structure des haplotypes BSEP et MDR3 chez les Caucasiens sains, les cirrhoses biliaires primaires et les cholangites sclérosantes primaires. Hepatology. (2004) 39:779-91. doi : 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Les variations des gènes ABCB4 et ABCB11 sont associées aux calculs intrahépatiques primaires. Mol Med Rep. (2015) 11:434-46. doi : 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. Le séquençage de FIC1, BSEP et MDR3 dans une grande cohorte de patients atteints de cholestase a révélé un nombre élevé de variantes génétiques différentes. J Hepatol. (2017) 67:1253-64. doi : 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
.