L’élément chimique fer est classé parmi les métaux de transition. Il est connu depuis l’Antiquité. Son découvreur et sa date de découverte sont inconnus.

Zone de données
| Classification : | Le fer est un métal de transition |
| Couleur: | gris argenté |
| Poids atomique: | 55.847 |
| État: | solide |
| Point de fusion: | 1535,1 oC, 1808.2 K |
| Point d’ébullition: | 2750 oC, 3023 K |
| Electrons : | 26 |
| Protons: | 26 |
| Neutrons dans l’isotope le plus abondant : | 30 |
| Ecoquilles électroniques : | 2,8,14,2 |
| Configuration électronique : | 3d6 4s2 |
| Densité à 20oC : | 7.87 g/cm3 |
Afficher plus, y compris : Chaleur, énergies, oxydation,
réactions, composés, rayons, conductivités
| Volume atomique: | 7,1 cm3/mol |
| Structure: | bcc : cubique centré sur le corps |
| Dureté : | 4,0 mohs |
| Capacité thermique spécifique | 0,44 J g-1 K-1 |
| Chaleur de fusion | 13.80 kJ mol-1 |
| Chaleur d’atomisation | 415 kJ mol-1 |
| Chaleur de vaporisation | 349.60 kJ mol-1 |
| Première énergie d’ionisation | 759,3 kJ mol-1 |
| 2ème énergie d’ionisation | 1561.1 kJ mol-1 |
| 3ème énergie d’ionisation | 2957.3 kJ mol-1 |
| Affinité électronique | 15.7 kJ mol-1 |
| Nombre minimal d’oxydation | -2 |
| Min. d’oxydation commun | 0 |
| Nombre d’oxydation maximum | 6 |
| Nombre d’oxydation commun max. | 3 |
| Electronégativité (échelle de Pauling) | 1,9 |
| Volume de polarisabilité | 8.4 Å3 |
| Réaction avec l’air | doux, ⇒ Fe3O4 |
| Réaction avec 15 M HNO3 | passivé |
| Réaction avec 6 M HCl | vigoureux, ⇒ H2, FeCl2 |
| Réaction avec 6 M NaOH | – |
| Oxyde(s) | FeO, Fe2O3 (hématite), Fe3O4 (magnétite) |
| Hydrure(s) | aucun |
| Chlorure(s) | FeCl2, FeCl3 |
| Rayon atomique | 140 pm |
| Rayon ionique (ion 1+) | – |
| Rayon ionique (2+ ion) | 77 pm |
| Rayon ionique (3+ ion) | 63 pm |
| Rayon ionique (1- ion) | – |
| Rayon ionique (2- ion) | – |
| Rayon ionique (3- ion) | – |
| Conductivité thermique | 80.4 W m-1 K-1 |
| Conductivité électrique | 11,2 x 106 S m-1 |
| Point de congélation/fusion: | 1535.1 oC, 1808,2 K |
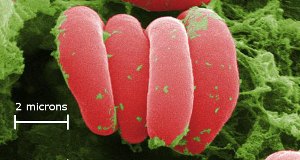
Cellules sanguines rouges – la couleur provient du fer dans l’hémoglobine. Les cellules sont agrandies x10 000. Si vous grossissez x10 000, vous pourriez placer vos pieds à Seattle et toucher Perth, en Australie, avec vos mains. Le fer contenu dans l’hémoglobine transporte l’oxygène dans notre corps. Image Ref. (10)

Fermeture d’une météorite de fer : Les météorites comme celle-ci étaient probablement la première source de fer de nos ancêtres. Il s’agit d’un fragment de la météorite Sikhote-Alin – environ 93% de fer, 6% de nickel et 1% d’autres éléments. La surface de la météorite a été fondue en forme d’empreinte de pouce pendant son vol à travers l’atmosphère de notre planète. Photo de Carl Allen, NASA JSC Photo S94-43472.

Les déchets de fer et d’acier à recycler. Comme les temps ont changé ; le fer valait autrefois huit fois plus que l’or.
Découverte du fer
Le fer est connu depuis l’Antiquité.
Le premier fer utilisé par les humains provient probablement de météorites.
La plupart des objets qui tombent sur terre depuis l’espace sont pierreux, mais une petite proportion, comme celle représentée, sont des « météorites de fer » dont la teneur en fer est supérieure à 90 %.
Le fer se corrode facilement, si bien que les artefacts en fer des temps anciens sont beaucoup plus rares que les objets en argent ou en or. Il est donc plus difficile de retracer l’histoire du fer que celle des métaux moins réactifs.
On a retrouvé des artefacts fabriqués à partir de fer météoritique datant d’environ 5000 ans avant JC (et donc vieux d’environ 7000 ans) – par exemple des perles de fer dans des tombes en Égypte. (1)
En Mésopotamie (Irak), il existe des preuves que les gens fondaient du fer vers 5000 avant JC.
On a trouvé des artefacts faits de fer fondu datant d’environ 3000 avant JC en Égypte et en Mésopotamie. (1), (2), (3)
À cette époque, le fer était un métal d’apparat ; il était trop cher pour être utilisé dans la vie quotidienne. Les écrits assyriens nous apprennent que le fer était huit fois plus précieux que l’or. (1)
L’âge du fer a commencé vers 1300-1200 av. J.-C. lorsque le fer est devenu assez bon marché pour remplacer le bronze.
L’ajout de carbone au fer pour faire de l’acier était probablement accidentel au début – une rencontre entre le fer fondu et le charbon de bois provenant du feu de fusion. Cela s’est probablement produit vers 1000 avant JC. (4)
Jusqu’à ce que cela se produise, il y avait peu de raisons technologiques pour que l’âge du bronze cède la place à l’âge du fer ; les techniques d’amélioration du fer par l’ajout de carbone (pour faire de l’acier) et le travail à froid étaient nécessaires avant que le fer soit entièrement préféré au bronze. (5)
Le fer était utilisé couramment à l’époque romaine. Au premier siècle, Pline l’Ancien disait : « C’est à l’aide du fer que nous construisons les maisons, que nous fendons les rochers et que nous accomplissons tant d’autres offices utiles dans la vie. » (6)
L’origine du symbole chimique Fe vient du mot latin ‘ferrum’ qui signifie fer. Le mot fer lui-même vient de « iren » en anglo-saxon.
Des faits intéressants sur le fer
- Un tiers de la masse de la Terre serait constitué de fer, dont la majeure partie se trouve au plus profond de la planète, dans le noyau.
- La Terre a assez de fer pour fabriquer trois nouvelles planètes, chacune ayant la même masse que Mars.
- La circulation du fer liquide dans les profondeurs de la terre serait à l’origine des courants électriques qui créent le champ magnétique de notre planète.
- Le fer est essentiel au développement du cerveau humain. Une carence en fer chez les enfants entraîne, entre autres, une altération de la capacité d’apprentissage. (7)
- Dans les temps anciens, les gens ne savaient pas à quel point le fer était très abondant sur Terre. Leur seule source de fer métallique était les météorites. Les écrits assyriens nous apprennent que le fer avait huit fois plus de valeur que l’or. Outre sa rareté, le fer était peut-être aussi très recherché car, venant du ciel, il était considéré comme un cadeau des dieux : les anciens Égyptiens l’appelaient « ba-ne-pe », ce qui signifie « métal du ciel ». Le lien avec le ciel est renforcé par les textes des pyramides qui se traduisent, par exemple, par : » mes os sont de fer et mes membres sont les étoiles impérissables « . (8) (9)
- Le fer a été le premier métal magnétique découvert. Les pierres de lune étaient utilisées par les navigateurs de l’Antiquité car elles pouvaient servir de boussoles, pointant vers le pôle nord magnétique ; ceci a été décrit par le philosophe grec antique Thalès de Milet en 600 avant JC. Les pierres de lune étaient fabriquées à partir de magnétite, qui est un oxyde de fer naturel. La formule de la magnétite est FeO.Fe2O3.
- Certains animaux ont un sixième sens – le sens magnétique. La magnétite a été trouvée dans un large éventail d’animaux, y compris les abeilles à miel, les pigeons voyageurs et les dauphins. Ces animaux sont sensibles au champ magnétique terrestre, ce qui les aide à s’orienter.
- La météorite de Hoba en Namibie est le plus gros morceau de fer naturel au monde, pesant plus de 60 tonnes. Elle est composée de 82 à 83 % de fer, 16 à 17 % de nickel, environ 1 % de cobalt et de très petites traces d’autres éléments. La météorite de Hoba est la plus grande météorite unique jamais découverte.
- Le fer est ferromagnétique. Le ferromagnétisme est le type de magnétisme le plus fort. Les autres métaux ferromagnétiques courants sont le nickel et le cobalt.
- Des aimants très puissants peuvent être fabriqués en utilisant du fer, du nickel ou du cobalt en association avec des métaux de terres rares. Les aimants NIB (Neodymium – Iron – Boron) ont été inventés au début des années 1980. Ils sont constitués d’un alliage dans les proportions Nd2Fe14B. Ils sont utilisés dans les ordinateurs, les téléphones portables, les équipements médicaux, les jouets, les moteurs, les éoliennes et les systèmes audio.



Apparence et caractéristiques
Effets nocifs :
Le fer est considéré comme non toxique.
Caractéristiques :
Le fer est un métal ductile, gris, relativement mou et est un modérément bon conducteur de chaleur et d’électricité.
Il est attiré par les aimants et peut être facilement magnétisé.
Le métal pur est chimiquement très réactif et rouille facilement dans l’air humide, formant des oxydes rouge-brun.
Il existe trois formes allotropiques du fer, dites alpha, gamma et delta.
Le fer alpha, également appelé ferrite, est la forme stable du fer à des températures normales.
Utilisations du fer
Le fer est le moins cher et le plus important de tous les métaux – important dans le sens où le fer est très majoritairement le métal le plus utilisé, représentant 95 % de la production mondiale de métaux.
Le fer est utilisé pour fabriquer l’acier et d’autres alliages importants dans la construction et la fabrication.
Le fer est également vital dans le fonctionnement des organismes vivants, transportant l’oxygène dans le sang via la molécule d’hémoglobine.
Abondance et isotopes
Abondance croûte terrestre : 5,6 % en poids, 2,1 % en moles
Abondance système solaire : 1000 parties par million en poids, 30 parties par million en moles
Coût, pur : 7,2 $ par 100g
Coût, en vrac : 0,02 $ par 100g
Source : Le fer n’est pas présent à l’état libre dans la nature mais se trouve dans des minerais de fer tels que l’hématite (Fe2O3), la magnétite (Fe3O4) et la taconite. Commercialement, le fer est produit dans un four à des températures d’environ 2000 oC par la réduction de l’hématite ou de la magnétite avec du carbone.
Isotopes : Le fer possède 24 isotopes dont les demi-vies sont connues, avec des numéros de masse de 46 à 69. Le fer naturel est un mélange de quatre isotopes et on les trouve dans les pourcentages indiqués : 54Fe (5,8%), 56Fe (91,8%), 57Fe (2,1%) et 58Fe (0,3%).

- Henry Maryon, Early Near Eastern Steel Swords., 65, 1961, American Journal of Archaeology p1.
- Michael D. Fenton, Mineral Commodity Profiles – Iron and Steel., 2005, U.S. Geological Survey.
- R. J. Forbes, Studies in Ancient Technology, IX, 1965, p247.
- Michael Woods, Mary B. Woods, Ancient Machines : From Wedges to Waterwheels., 2000, p30, Runestone Press.
- Vincent C. Pigott, The Archaeometallurgy of the Asian Old World, 1999, p28, UPenn Museum of Archaeology.
- Mary Elvira Weeks, Discovery of the Elements., 2003, p5, Kessinger Publishing.
- http://www.ncbi.nlm.nih.gov/pubmed/17101454.
- John G. Burke, Les débris cosmiques : Les météorites dans l’histoire., 1986, p229, University of California Press.
- Robert G. Bauval, Enquête sur les origines de la pierre de Benben. 14, 1989, Discussions en égyptologie.
- Image : CDC
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/iron.html">Iron</a>
ou
<a href="https://www.chemicool.com/elements/iron.html">Iron Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation conforme à la norme MLA suivante:
"Iron." Chemicool Periodic Table. Chemicool.com. 06 Oct. 2012. Web. <https://www.chemicool.com/elements/iron.html>.
.