
Les dimères moléculaires sont souvent formés par la réaction de deux composés identiques, par exemple : 2A → A-A. Dans cet exemple, on dit que le monomère « A » se dimérise pour donner le dimère « A-A ». Un exemple est un diaminocarbène, qui se dimérise pour donner un tétraaminoéthylène :
2 C(NR2)2 → (R2N)2C=C(NR2)2
Les carbènes sont très réactifs et forment facilement des liaisons.
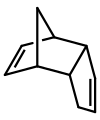
Le dicyclopentadiène est un dimère asymétrique de deux molécules de cyclopentadiène qui ont réagi dans une réaction de Diels-Alder pour donner le produit. En chauffant, il se » fissure » (subit une réaction de rétro-Diels-Alder) pour donner des monomères identiques :
C10H12 → 2 C5H6
De nombreux éléments non métalliques se présentent sous forme de dimères : l’hydrogène, l’azote, l’oxygène, les halogènes, c’est-à-dire le fluor, le chlore, le brome et l’iode. Les gaz nobles peuvent former des dimères liés par des liaisons de van der Waals, par exemple le dihélium ou le diargon. Le mercure se présente sous la forme d’un cation mercure(I) (Hg22+), qui est officiellement un ion dimère. D’autres métaux peuvent former une proportion de dimères dans leur vapeur. Les dimères métalliques connus comprennent Li2, Na2, K2, Rb2 et Cs2.
Plusieurs petites molécules organiques, plus particulièrement le formaldéhyde, forment facilement des dimères. Le dimère du formaldéhyde (CH2O) est le dioxétane (C2H4O2).