
La production de cyclopentadiène n’est généralement pas distinguée de celle du dicyclopentadiène car ils s’intervertissent. Ils sont obtenus à partir du goudron de houille (environ 10-20 g/tonne) et par vapocraquage du naphta (environ 14 kg/tonne). Pour obtenir le monomère cyclopentadiène, le dicyclopentadiène commercial est craqué par chauffage à environ 180 °C. Le monomère est recueilli par distillation, et utilisé peu après.
Réarrangement sigmatropiqueEdit
Les atomes d’hydrogène du cyclopentadiène subissent des déplacements -sigmatropiques rapides, comme l’indiquent les spectres de RMN 1H enregistrés à diverses températures. Encore plus fluxionnels sont les dérivés C5H5E(CH3)3 (E = Si, Ge, Sn), dans lesquels l’élément le plus lourd migre de carbone en carbone avec une faible barrière d’activation.
Réactions de Diels-AlderEdit
Le cyclopentadiène est un diène très réactif dans la réaction de Diels-Alder parce qu’une distorsion minimale du diène est nécessaire pour obtenir la géométrie d’enveloppe de l’état de transition par rapport aux autres diènes. Le cyclopentadiène se dimérise. La conversion se produit en quelques heures à température ambiante, mais le monomère peut être stocké pendant des jours à -20 °C.
DéprotonationModifié
Le composé est exceptionnellement acide (pKa = 16) pour un hydrocarbure, un fait expliqué par la grande stabilité de l’anion cyclopentadiényle aromatique, C
5H-
5. La déprotonation peut être réalisée avec une variété de bases, typiquement l’hydrure de sodium, le sodium métallique et le butyl-lithium. Des sels de cet anion sont disponibles dans le commerce, notamment le cyclopentadiènide de sodium et le cyclopentadiènide de lithium. Ils sont utilisés pour préparer des complexes de cyclopentadiényle.
Dérivés de métallocèneModifier
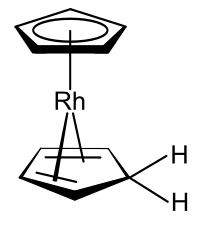
Les métallocènes et les dérivés cyclopentadiényliques apparentés ont fait l’objet de nombreuses recherches et représentent une pierre angulaire de la chimie organométallique en raison de leur grande stabilité. Le premier métallocène caractérisé, le ferrocène, a été préparé de la même manière que de nombreux autres métallocènes : en combinant des dérivés de métaux alcalins de forme MC5H5 avec des dihalogénures des métaux de transition : Comme exemple typique, le nickelocène se forme en traitant le chlorure de nickel(II) avec le cyclopentadiénure de sodium dans le THF.
NiCl2 + 2 NaC5H5 → Ni(C5H5)2 + 2 NaCl
On connaît des complexes organométalliques qui comprennent à la fois l’anion cyclopentadiényle et le cyclopentadiène lui-même, dont un exemple est le dérivé du rhodocène produit à partir du monomère rhodocène dans des solvants protiques.
Synthèse organiqueModifié
Il a été la matière première de la synthèse du dodécaèdre réalisée par Léo Paquette en 1982. La première étape impliquait une dimérisation réductrice de la molécule pour donner du dihydrofulvalène, et non une simple addition pour donner du dicyclopentadiène.

.