1. Perméabilité
2. fluidité
3. hétérogénéité
– interne
– externe
– courbure, épaisseur
Les fonctions des membranes cellulaires sont déterminées par leur composition moléculaire. Le type et la proportion de ces molécules vont fixer les caractéristiques physico-chimiques membranaires : semi-perméabilité, asymétrie, fluidité, réparation et recyclage.
Perméabilité
La semi-perméabilité membranaire est une conséquence de l’environnement hydrophobe interne des membranes, créé par les chaînes d’acides gras lipidiques, difficilement franchissable par des molécules ayant des charges électriques. Ainsi, en empêchant la diffusion libre des molécules, les membranes peuvent former des compartiments qui conservent des environnements internes et externes distincts. Cependant, la perméabilité est sélective. La polarité et la taille sont les caractéristiques moléculaires les plus importantes qui influencent la capacité à traverser les membranes. Les petites molécules sans charge électrique, comme le CO2, le N2, l’O2, et les molécules à forte solubilité dans les graisses comme l’éthanol, peuvent traverser les membranes presque librement par diffusion passive (figure 1). La perméabilité est plus faible pour les molécules qui ont des charges électriques lorsque le nombre de charges positives est égal aux charges négatives, appelées molécules non chargées, comme l’eau et le glycérol. On pourrait penser que l’eau peut traverser les membranes librement, mais il existe certaines restrictions, et c’est pourquoi certaines membranes contiennent des aquaporines, un type de protéine transmembranaire avec un canal qui permet à l’eau de traverser librement. La capacité des grosses molécules non chargées, comme le glucose, à traverser les membranes est faible. Les membranes sont très imperméables aux ions et aux molécules chargées. Voici quelques valeurs pour le coefficient de perméabilité par diffusion passive : O2 : 2,3 cm/s, CO2 : 0,35 cm/s, H2O : 0,0034 cm/s, glycérol : 10 -6 cm/s, sodium et potassium : 10 -14 cm/s.
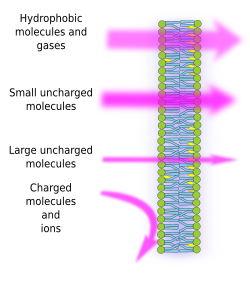
La distribution inégale des ions et des molécules entre les deux côtés d’une membrane permet de générer et de maintenir des gradients électrochimiques. La différence entre la concentration interne et externe des charges électriques est appelée potentiel de membrane. Ce gradient est utilisé pour de nombreuses fonctions cellulaires, comme la synthèse de l’ATP et la transmission d’informations le long des nerfs. La semi-perméabilité est également responsable des processus osmotiques, qui sont des mouvements d’eau à travers les membranes, d’une solution moins concentrée d’un côté vers une solution plus concentrée de l’autre, afin d’égaliser les deux concentrations. Ainsi, les cellules végétales sont capables d’augmenter de taille grâce à une concentration intracellulaire plus élevée de certains solutés qui font entrer de l’eau dans la cellule, ce qui produit à son tour une pression hydrostatique interne (appelée pression de turgescence) qui pousse les parois cellulaires vers l’extérieur. Les molécules qui ne traversent pas librement les membranes sont utiles aux cellules car elles peuvent créer des gradients qui peuvent fonctionner comme des mécanismes d’information ou comme des réserves d’énergie. Les cellules possèdent des protéines transmembranaires qui permettent de traverser la membrane ou de déplacer des molécules chargées et des ions entre les deux côtés des membranes cellulaires, en évitant l’environnement hydrophobe de la membrane interne. Par exemple, la contraction musculaire est déclenchée par l’ouverture de canaux qui réduisent un gradient ionique existant.
La semi-perméabilité est influencée par la composition lipidique des membranes. Par exemple, la teneur en cholestérol est importante dans la membrane plasmique. Une augmentation de la teneur en cholestérol diminue la fluidité et augmente l’hydrophobie, ces deux caractéristiques rendant la membrane plus imperméable. Ainsi, l’augmentation du cholestérol au-delà de 30 % (qui est une valeur élevée) rend les membranes de myéline très adaptées pour isoler les axones et optimiser la propagation du potentiel d’action le long de l’axone.
Fluidité et domaines latéraux
La fluidité est une propriété des membranes. Elle est liée à la capacité des molécules à se déplacer à l’intérieur des membranes. Une plus grande fluidité signifie que les mouvements sont plus fréquents. Les membranes cellulaires sont en fait une feuille de graisse, où les molécules sont dans un état visqueux semi liquide. On peut donc supposer que les molécules peuvent se déplacer par diffusion. Par exemple, un glycérophospholipide situé dans la monocouche externe de la membrane plasmique peut avoir deux types de mouvements : latéral, c’est-à-dire dans la même monocouche, et flip-flop, c’est-à-dire en sautant d’une monocouche à l’autre (Figure 2). Dans les membranes artificielles, ces deux types de mouvements ont été observés, les mouvements latéraux étant beaucoup plus fréquents que le flip-flop. Par diffusion latérale, les lipides peuvent parcourir 30 µm en 20 secondes ; ils peuvent parcourir toute la circonférence d’une cellule de taille moyenne en une minute. Cependant, les mouvements de bascule sont vraiment peu fréquents car la tête hydrophile de la molécule lipidique doit traverser la couche interne des chaînes d’acides gras, ce qui est thermodynamiquement difficile. Pour une molécule lipidique, la probabilité d’un mouvement de bascule est d’environ une fois par mois. Cependant, le cholestérol se comporte différemment et peut faire volte-face assez facilement.

La fluidité membranaire peut changer en fonction de la composition chimique. En général, des chaînes d’acides gras plus courtes et une quantité plus élevée de liaisons insaturées entre les carbones des acides gras augmentent la fluidité de la membrane. La quantité de cholestérol influence également la fluidité de la membrane mais l’effet net dépend de la température et du type de lipides dans la membrane. Le cholestérol a deux effets : il inhibe la transition vers un état de gel solide (moins de fluidité), mais il diminue également la flexibilité des chaînes d’acides gras insaturés. En général, on peut dire qu’une augmentation de la concentration de cholestérol diminue la fluidité de la membrane, bien qu’à basse température, l’effet soit inverse. Les membranes internes de la cellule, comme celles du réticulum endoplasmique, contiennent très peu de cholestérol et sont donc plus fluides. En outre, le cholestérol confère aux membranes une autre propriété appelée hidrophobie, qui rend les membranes plus imperméables.
La différence de composition moléculaire entre les deux monocouches d’une membrane, appelée asymétrie membranaire, peut générer une fluidité distincte dans chaque monocouche. Selon la composition moléculaire, les lipides peuvent se trouver dans deux phases physiques : liquide-ordonnée (moins de fluidité) et liquide-désorientée (plus de fluidité). La monocouche externe de la membrane plasmique est supposée être plus fréquemment en phase liquide-ordonnée, alors que la monocouche interne est encline à être en phase liquide-désorientée.
Les cellules peuvent modifier la fluidité des membranes en changeant leur composition chimique. Par exemple, les bactéries ajustent la saturation et la longueur des chaînes d’acides gras afin que la fluidité de la membrane puisse être adaptée aux conditions environnementales. La variation de la concentration en glycérophospholipides, comme la phosphatidyléthanolamine, peut également moduler la fluidité. Certains insectes ne peuvent pas synthétiser les stérols, comme le cholestérol, et les stérols de leurs membranes proviennent de la nourriture. Ils modifient la fluidité de leurs membranes cellulaires par différentes concentrations de phosphatidyléthanolamine.
La membrane interne des mitochondries doit être une forte barrière imperméable pour créer et maintenir un gradient de protons. Cela pourrait se faire par une augmentation de la teneur en cholestérol. De cette façon, l’hidrophobie est plus élevée, mais en retour le cholestérol diminue la fluidité, ce qui semble être très important pour la fonction des protéines dans cette membrane. Les mitochondries résolvent le problème avec la cardiolipine, un phospholipide insaturé qui augmente l’hidrophobie, mais ne réduit pas beaucoup la fluidité de la membrane.
3. Hétérogénéité
En raison de la fluidité, on peut penser que les protéines sont distribuées de façon aléatoire et que, par conséquent, les membranes sont homogènes en ce qui concerne la composition moléculaire, c’est-à-dire qu’elles présentent le même contenu moléculaire et la même proportion indépendamment de la région membranaire. Ce n’est pas le cas. Il existe des restrictions à la diffusion latérale des molécules qui provoquent l’hétérogénéité de la membrane, ce qui signifie qu’il existe des régions de la membrane ayant une composition moléculaire différente. Dans les cellules non polarisées, et à des échelles supérieures à 200 nm, la membrane plasmique semble homogène, mais à des échelles inférieures à 200 nm, elle est hétérogène. On pense que les microdomaines des membranes ont une taille d’environ 60 µm. Les lipides et les protéines présentent des mouvements latéraux limités à des zones de 60 à 200 nm pendant quelques millisecondes, puis ils sautent dans une autre zone adjacente où ils restent pendant un autre court moment. Ce comportement est appelé diffusion saltatoire.
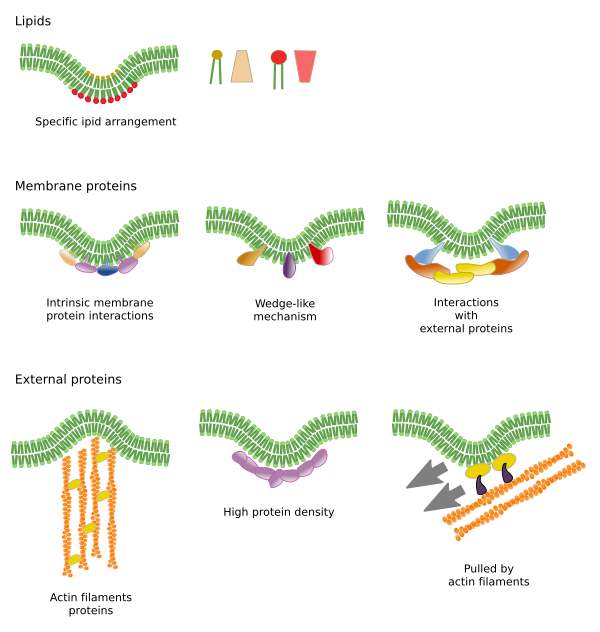
Les restrictions aux mouvements latéraux des molécules peuvent être causées par plusieurs mécanismes : interactions avec le cytosquelette ou la matrice extracellulaire, interactions des molécules membranaires entre elles, densités différentes des zones locales de la membrane (changements de fluidité), quantité de charges électriques, courbure de la membrane et épaisseur différente des domaines membranaires (figure 3).
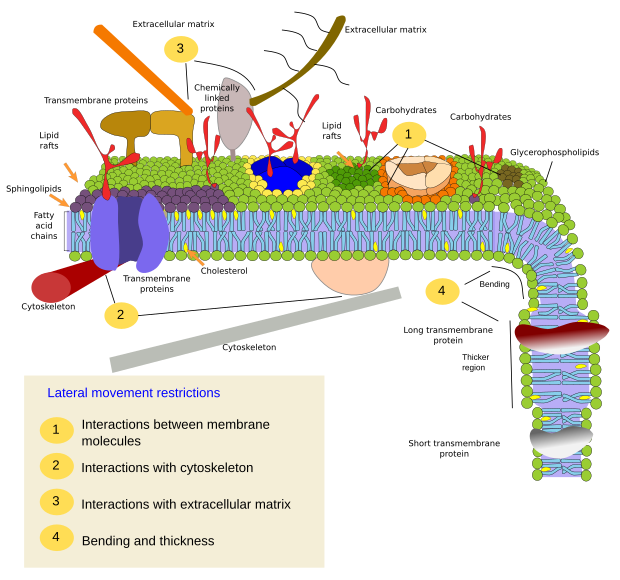
Interactions internes
Les interactions des molécules membranaires entre elles contraignent les mouvements latéraux. Les deux, les mouvements des protéines et des lipides sont influencés par ces interactions conduisant à la formation de microdomaines avec une composition moléculaire différentielle (Figure 4). Il en résulte une distribution latérale hétérogène des molécules dans les membranes. Selon les proportions moléculaires, les microdomaines lipidiques peuvent avoir une densité différente (c’est-à-dire une fluidité différente) : solide, liquide ordonné et liquide désordonné. La densité la plus courante est le liquide désordonné, qui est le plus fluide.
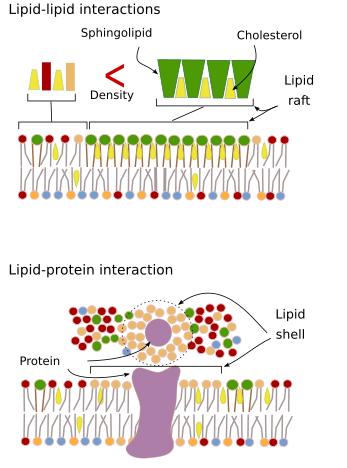
Les sphingolipides et le cholestérol peuvent s’associer spontanément entre eux, réduisant leur motilité et augmentant la densité moléculaire par rapport aux zones voisines. Un petit groupe distinct de molécules se forme comme un radeau dans une mer de lipides. En fait, ces associations moléculaires sont connues sous le nom de radeaux lipidiques, et on pense qu’elles sont très abondantes dans les membranes cellulaires. Les radeaux lipidiques ont un comportement très dynamique, ils peuvent se déplacer, croître, diminuer, apparaître et disparaître. En effet, les membranes sont constituées de nombreux domaines denses se déplaçant latéralement parmi les glycérophospholipides, de sorte que les membranes sont assez hétérogènes en ce qui concerne leur distribution moléculaire. Certaines expériences suggèrent que certains types de protéines « se sentent » plus à l’aise à l’intérieur des radeaux lipidiques. Ces protéines passent plus de temps à l’intérieur qu’à l’extérieur des radeaux lipidiques, elles voyagent donc pendant un certain temps à l’intérieur de ces densités. Cela entraîne une ségrégation des molécules le long de la membrane et augmente la probabilité que différentes molécules se trouvent à proximité les unes des autres plus longtemps que par hasard (diffusion), augmentant ainsi la probabilité de certaines réactions moléculaires. En outre, il est suggéré qu’une concentration élevée de certains types de lipides dans les radeaux lipidiques crée un environnement chimique distinct qui facilite certaines réactions chimiques ou interactions moléculaires. Il a été proposé que les radeaux lipidiques soient présents dans la monocouche externe de la membrane plasmique car c’est de ce côté que les sphingolipides sont abondants. On a suggéré que les domaines membranaires existent aussi dans les membranes des organites, et on pense que certaines de leurs fonctions reposent sur ces domaines membranaires.
Dans la monocouche interne de la membrane plasmique, des microdomaines sont formés par des interactions électrostatiques entre les domaines cytosoliques basiques ou les domaines de cations divalents des protéines et les têtes polaires négatives des lipides. Un autre exemple moins connu est l’association entre le phosphatidylinositol bisphosphate et le cholestérol qui forme des microdomaines dans cette monocouche. Ces microdomaines tournés vers le cytosol peuvent influencer les échafaudages protéiques intracellulaires.
Traditionnellement, on pense qu’il n’y a pas d’interactions entre les deux monocouches de membranes et qu’elles distribuent leurs microdomaines indépendamment. Cependant, des preuves suggèrent qu’il existe des interactions entre elles. Les protéines transmembranaires affectent simultanément les deux monocouches puisqu’elles traversent toute la membrane. Une autre façon de synchroniser les deux monocouches peut être médiée par les longues chaînes d’acides gras, comme certaines sphingolipides qui peuvent avoir 24 carbones de long (la longueur normale est de 18). Ces longues chaînes peuvent s’insérer parmi les chaînes d’acides gras des lipides de l’autre monocouche et influencer la distribution lipidique. En outre, on pense que les domaines lipidiques à longues chaînes d’acides gras sont contrebalancés par des microdomaines lipidiques à courtes chaînes d’acides gras dans l’autre monocouche, ce qui maintient constante l’épaisseur de la membrane.
Les protéines membranaires, intégrales et associées, peuvent également interagir entre elles et s’assembler en échafaudages macromoléculaires pour faciliter la transmission de l’information, la reconnaissance cellule-cellule, le démarrage de certaines activités enzymatiques et le mouvement cellulaire. Il existe également des protéines multimériques qui ne sont actives que lorsque toutes les sous-unités sont réunies. Par exemple, le récepteur de l’insuline est constitué de quatre sous-unités. Les protéines et les lipides peuvent également interagir pour former des domaines membranaires. Par exemple, dans la monocouche interne, le phosphatidylinositol s’associe autour des protéines par des interactions électriques, qui peuvent être régulées en modifiant les phosphates de la tête polaire des lipides.
Interactions avec les éléments externes
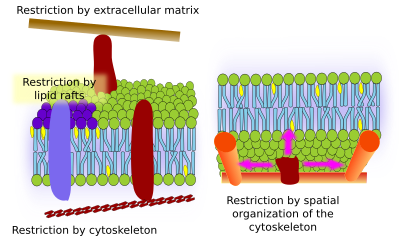
Les protéines membranaires intégrales peuvent également avoir des mouvements latéraux, mais ils sont plus restreints que les lipides, principalement en raison des interactions avec la matrice extracellulaire et le cytosquelette à travers leurs domaines extracellulaires et intracellulaires, respectivement (Figure 5). Ces interactions peuvent maintenir les protéines dans de petites zones de la membrane pendant plus longtemps que par simple diffusion. Le cytosquelette peut former des barrières juste sous la membrane plasmique qui maintiennent les protéines dans de petites zones. Les filaments d’actine et les microtubules peuvent entourer de petites zones qui limitent la diffusion des protéines et des lipides. Les interactions avec le cytosquelette sont importantes car si le cytosquelette est expérimentalement désorganisé, la membrane devient beaucoup plus homogène. Les cellules disposent d’autres mécanismes pour confiner les protéines dans des domaines spécifiques. Par exemple, dans les cellules épithéliales de l’intestin, certains transporteurs et enzymes sont situés dans la membrane plasmique apicale, mais pas dans le domaine baso-latéral en raison d’une ceinture de jonctions serrées, une fermeture éclair moléculaire qui empêche la diffusion entre les domaines apical et baso-latéral. Cette distribution asymétrique est essentielle pour la physiologie de la cellule épithéliale.
La courbure membranaire est un autre moyen de créer des microdomaines. Une courbure de la membrane peut être le point de départ pour former une vésicule, une extension du cytoplasme pour l’expansion cellulaire, un changement de forme ou la croissance d’un organite, ou simplement pour commencer une barrière pour restreindre le mouvement latéral des molécules. Il s’agit d’une restriction physique par la disposition 3D des lipides dans le plus petit angle du pli de la membrane.
Les outils moléculaires nécessaires pour plier une membrane sont recrutés dans des régions spécifiques de la membrane. Ces microdomaines peuvent avoir une composition lipidique spécifique ou un environnement de charge électrique particulier. Les phosphoinositides (PIP), principalement les PIP2 et PIP3, sont des lipides qui contribuent au recrutement des protéines pour plier la membrane. Ce sont des molécules utiles car la charge électrique et la structure moléculaire de leurs têtes polaires peuvent être facilement modifiées par des réactions chimiques. De cette façon, les propriétés d’une région membranaire particulière peuvent changer en cas de besoin et recruter des protéines spécifiques. La phosphatidylsérine est également capable d’initier un microdomaine pour la courbure de la membrane lorsqu’elle est transloquée d’une monocouche à l’autre par les flipases.
Courbure et épaississements
Les microdomaines lipidiques recrutent des protéines qui courbent efficacement la membrane. Il existe des protéines spécialisées dans ce rôle (figure 6). Les protéines à domaine BAR (Bin/amphyphysine/Rsv161) sont l’une d’entre elles. La courbure peut être induite par deux mécanismes : l’assemblage d’un échafaudage courbe de protéines qui tirent ou poussent la membrane, et l’insertion de séquences d’acides aminés parmi les lipides comme un coin. Par exemple, les cavéolines provoquent la courbure de la membrane pour former des caveloae, la tétraspaïne force les membranes à former des tubules, l’ESCRT aide à la formation de vésicules à l’intérieur des endosomes pour former des corps multivésiculaires. L’actine est un puissant agent de courbure de la membrane par la polymérisation des filaments d’actine qui pousse la membrane plasmique vers l’extérieur conduisant à des expansions cellulaires. De nombreuses protéines qui peuvent courber la membrane plasmique activent également la polymérisation de l’actine.
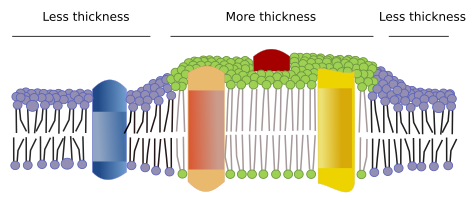
Il existe d’autres domaines dans les membranes, les domaines physiques, formés par des molécules comme les protéines transmembranaires. Ces domaines présentent une épaisseur de membrane différente car ils contiennent des protéines avec des séquences d’acides aminés hydrophobes plus longues qui s’entourent de lipides avec des chaînes d’acides gras plus longues (figure 7). Ces protéines et ces lipides se « sentent » plus à l’aise lorsqu’ils sont ensemble car ils s’ajustent correctement à leurs parties hydrophobes. Ils forment des domaines membranaires qui excluent les autres molécules, protéines ou lipides, dont les régions hydrophobes sont plus courtes.
Bibliografía
Honigmann A, Pralle A. (2016). Compartimentation de la membrane cellulaire. Journal of mollecular biology. 428 : 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Courbure membranaire en biologie cellulaire : une intégration des mécanismes moléculaires. Journal of cell biology. 214 : 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Haut cholestérol / bas cholestérol : effets dans les biologicalmembranes : une revue Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.