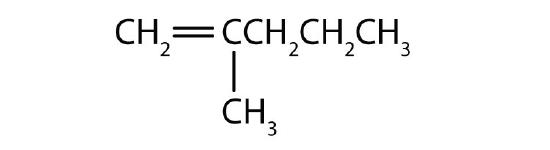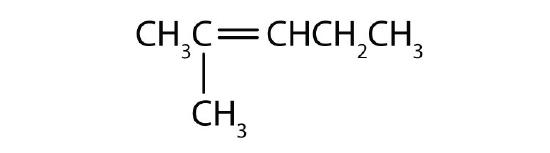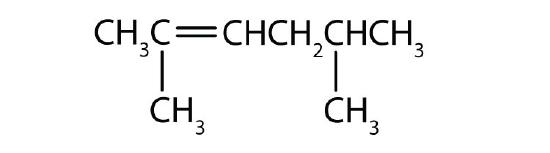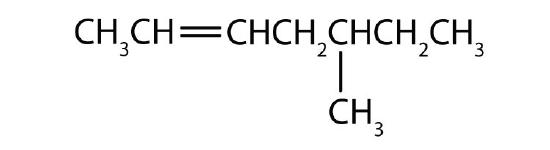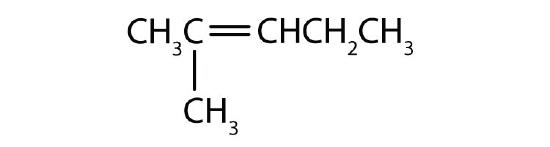Objectifs d’apprentissage
- Nommer des alcènes donnés par des formules et écrire des formules pour des alcènes donnés par des noms.
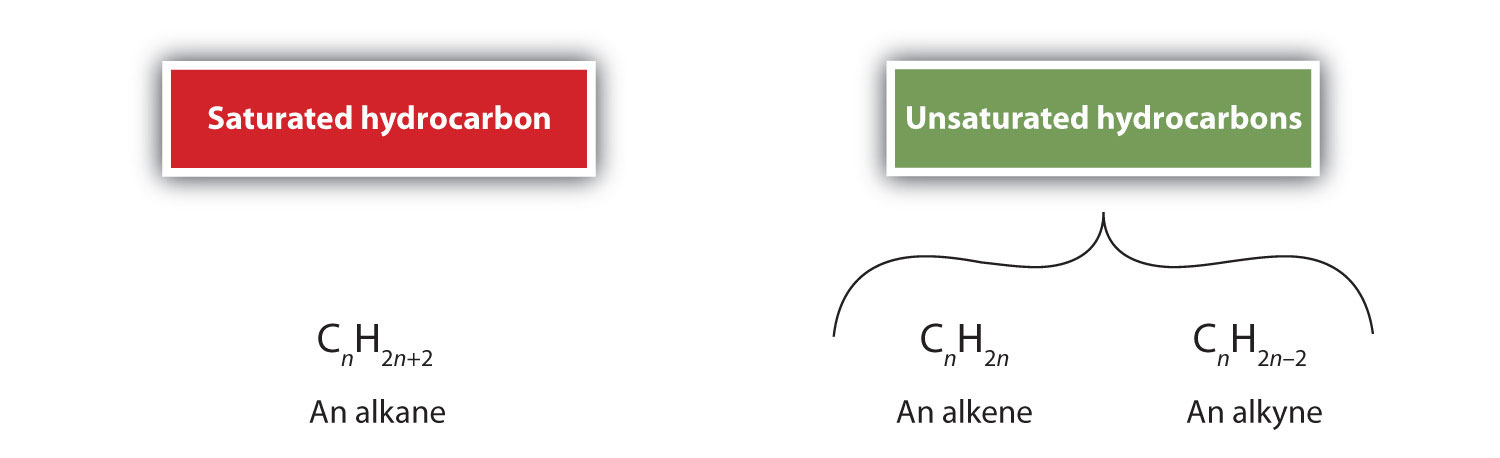
Comme indiqué précédemment, les alcènes sont des hydrocarbures avec des doubles liaisons carbone-carbone (R2C=CR2) et les alcynes sont des hydrocarbures avec des triples liaisons carbone-carbone (R-C≡C-R). Collectivement, ils sont appelés hydrocarbures insaturés parce qu’ils ont moins d’atomes d’hydrogène qu’un alcane avec le même nombre d’atomes de carbone, comme l’indiquent les formules générales suivantes :
Certains alcènes représentatifs – leurs noms, leurs structures et leurs propriétés physiques – sont donnés dans le tableau \(\PageIndex{1}\).
| Nom IUPAC | Formule moléculaire | Formule structurale condensée | Point de fusion (°C) | Point d’ébullition (°C) |
|---|---|---|---|---|
| éthène | C2H4 | CH2=CH2 | -169 | -104 |
| propène | C3H6 | CH2=CHCH3 | -185 | -47 |
| 1-butène | C4H8 | CH2=CHCH2CH3 | -185 | -6 |
| 1-pentène | C5H10 | CH2=CH(CH2)2CH3 | -138 | 30 |
| 1-hexène | C6H12 | CH2=CH(CH2)3CH3 | -140 | 63 |
| 1-heptene | C7H14 | CH2=CH(CH2)4CH3 | -119 | 94 |
| 1-octène | C8H16 | CH2=CH(CH2)5CH3 | -102 | 121 |
Nous n’avons utilisé que des formules structurelles condensées dans le tableau (\PageIndex{1}\). Ainsi, CH2=CH2 signifie
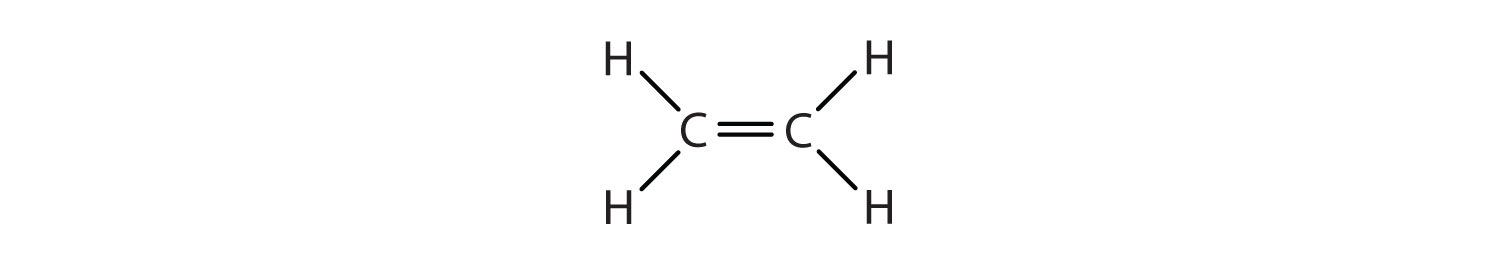
La double liaison est partagée par les deux carbones et n’implique pas les atomes d’hydrogène, bien que la formule condensée ne rende pas ce point évident. Notez que la formule moléculaire de l’éthène est C2H4, alors que celle de l’éthane est C2H6.
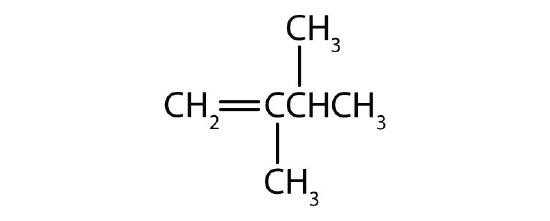
Les deux premiers alcènes du tableau \(\PageIndex{1}\), l’éthène et le propène, sont le plus souvent appelés par leurs noms communs – éthylène et propylène, respectivement (Figure \(\PageIndex{1}\)). L’éthylène est un produit chimique commercial majeur. L’industrie chimique américaine produit environ 25 milliards de kilogrammes d’éthylène par an, soit plus que tout autre produit chimique organique synthétique. Plus de la moitié de cet éthylène entre dans la fabrication du polyéthylène, l’une des matières plastiques les plus connues. Le propylène est également un produit chimique industriel important. Il est transformé en plastiques, en alcool isopropylique et en une variété d’autres produits.

Bien qu’il n’existe qu’un seul alcène de formule C2H4 (éthène) et un seul de formule C3H6 (propène), il existe plusieurs alcènes de formule C4H8.
Voici quelques règles de base pour nommer les alcènes selon l’Union internationale de chimie pure et appliquée (UICPA) :
- La plus longue chaîne d’atomes de carbone contenant la double liaison est considérée comme la chaîne mère. Elle est nommée en utilisant la même tige que l’alcane ayant le même nombre d’atomes de carbone mais se termine par -ène pour l’identifier comme alcène. Ainsi, le composé CH2=CHCH3 est le propène.
- S’il y a quatre atomes de carbone ou plus dans une chaîne, on doit indiquer la position de la double liaison. Les atomes de carbone sont numérotés de façon à ce que le premier des deux qui sont doublement liés reçoive le plus petit des deux numéros possibles.Le composé CH3CH=CHCH2CH3, par exemple, a la double liaison entre les deuxième et troisième atomes de carbone. Son nom est 2-pentène (et non 3-pentène).
- Les groupes substituants sont nommés comme pour les alcanes, et leur position est indiquée par un nombre. Ainsi, la structure ci-dessous est celle du 5-méthyl-2-hexène. Notez que la numérotation de la chaîne mère est toujours effectuée de manière à donner à la double liaison le numéro le plus bas, même si cela fait qu’un substituant a un numéro plus élevé. La double liaison est toujours prioritaire dans la numérotation.
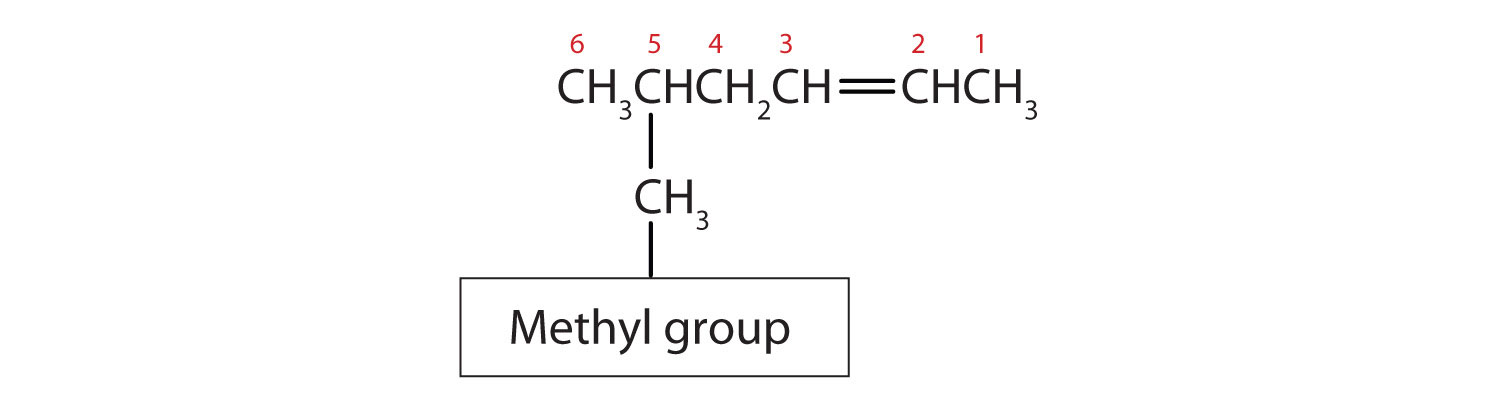
Exemple \(\PageIndex{1}\)
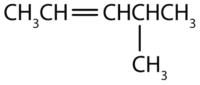
Nommer chaque composé.
Solution
- La chaîne la plus longue contenant la double liaison possède cinq atomes de carbone, le composé est donc un pentène (règle 1). Pour donner au premier atome de carbone de la double liaison le numéro le plus bas (règle 2), on numérote à partir de la gauche, le composé est donc un 2-pentène. Il y a un groupe méthyle sur le quatrième atome de carbone (règle 3), donc le nom du composé est 4-méthyl-2-pentène.
- La chaîne la plus longue contenant la double liaison a cinq atomes de carbone, donc le composé parent est un pentène (règle 1). Pour donner au premier atome de carbone de la double liaison le plus petit nombre (règle 2), on numérote à partir de la gauche, le composé est donc un 2-pentène. Il y a un groupe méthyle sur le troisième atome de carbone (règle 3), le nom du composé est donc 3-méthyl-2-pentène.
Exercice \(\PageIndex{1}\)
Nommez chaque composé.
-
CH3CH2CH2CH2CH=CHCH3
-
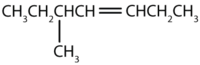
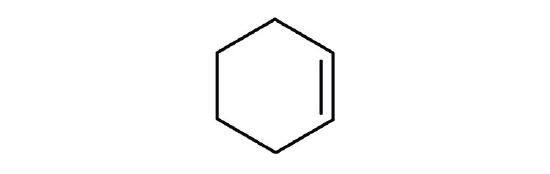
De même qu’il existe des cycloalcanes, il existe des cycloalcènes. Ces composés sont nommés comme les alcènes, mais avec le préfixe cyclo- attaché au début du nom de l’alcène parent.
Exemple \(\PageIndex{2}\)
Dessinez la structure de chaque composé.
- 3-méthyl-2-pentène
- cyclohexène
Solution
- Écrivez d’abord la chaîne mère de cinq atomes de carbone : C-C-C-C-C. Ajoutez ensuite la double liaison entre les deuxième et troisième atomes de carbone :
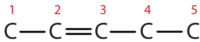
Prenez maintenant le groupe méthyle sur le troisième atome de carbone et ajoutez suffisamment d’atomes d’hydrogène pour donner à chaque atome de carbone un total de quatre liaisons.
- D’abord, considérez ce que chacune des trois parties du nom signifie. Cyclo signifie un composé cyclique, hex signifie 6 atomes de carbone, et -ène signifie une double liaison.

Exercice \(\PageIndex{2}\)
Dessinez la structure de chaque composé.
- 2-éthyl-1-hexène
- cyclopentène
Exercices de révision des concepts
-
Identifiez brièvement les distinctions importantes entre un hydrocarbure saturé et un hydrocarbure insaturé.
-
Identifiez brièvement les distinctions importantes entre un alcène et un alcane.
-
Classez chaque composé comme saturé ou insaturé. Identifiez chacun comme un alcane, un alcène ou un alcyne.
-
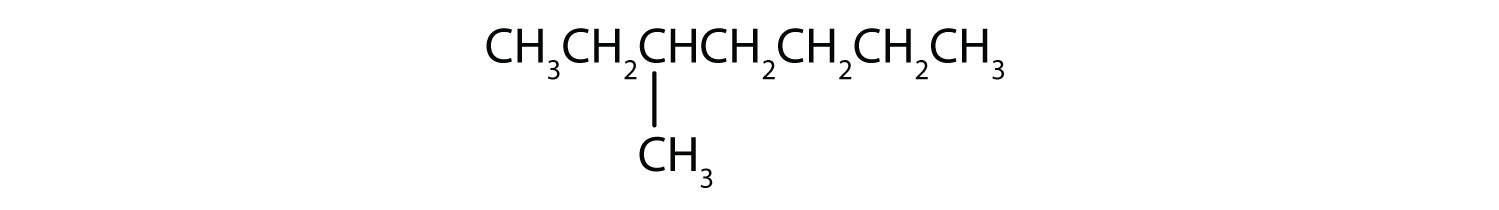
- CH3CH2C≡CCH3
-
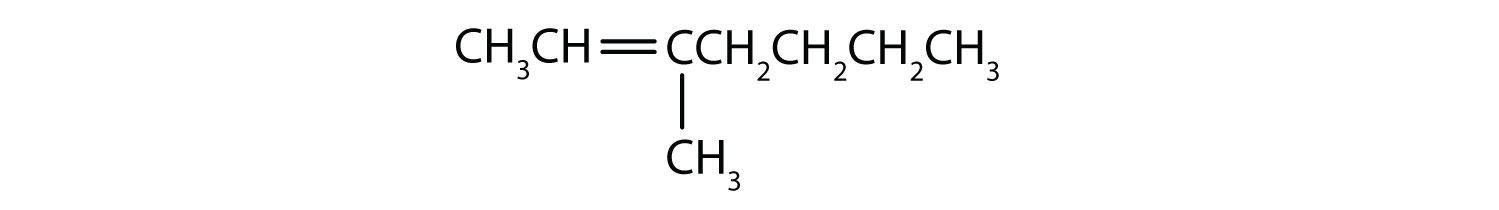
-
Réponses
-
Les hydrocarbures insaturés ont des liaisons doubles ou triples et sont assez réactifs ; les hydrocarbures saturés n’ont que des liaisons simples et sont assez peu réactifs.
-
Un alcène possède une double liaison ; un alcane ne possède que des liaisons simples.
-
- saturé ; alcane
- non saturé ; alcyne
- non saturé ; alcène
Prises clés
- Les alcènes sont des hydrocarbures comportant une double liaison carbone-carbone.
Exercices
-
Dessinez la structure de chaque composé.
- 2-méthyl-2-pentène
- 2,3-diméthyl-1-butène
- cyclohexène
-
Dessinez la structure de chaque composé.
- 5-méthyl-1-hexène
- 3-éthyl-2-pentène
- 4-méthyl-2-hexène
-
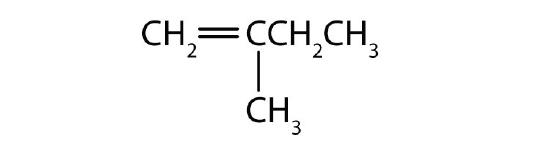
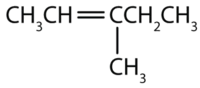
Nommer chaque composé selon le système IUPAC.
-
-
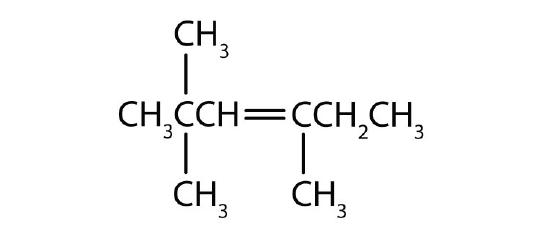
Nommer chaque composé selon le système IUPAC.
-
Réponses
- .
-
-
-
- 2-methyl-1-pentene
- 2-methyl-2-pentene
- 2,5-diméthyl-2-hexène
.